Struktura plinastih, tekočih in trdnih teles je kratka
Pod določenimi pogoji je vsa snov na planetu Zemlja prisotna v enem od treh stanj: plinastih, tekočih ali trdnih. Obstaja tudi četrto stanje snovi, imenovano plazma. Razmislite o strukturi plinastih, tekočih in trdnih teles ter o njihovem prehodu iz enega stanja v drugega, ko se zunanji pogoji spremenijo.
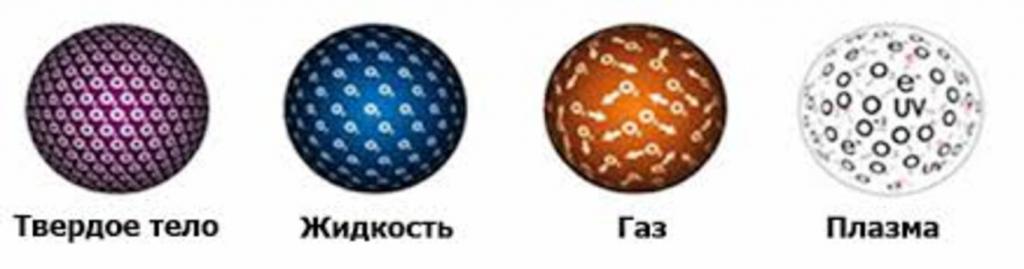
Trdno stanje snovi
Za trdne snovi je značilna sposobnost, da se uprejo zunanjim silam, ki jih vplivajo, da bi spremenile svojo obliko in prostornino. Glede na strukturo plinastih, tekočih in trdnih teles ter na slednje je treba povedati, da so molekule v njih trdno povezane. Zato ima objekt določeno obliko, ki jo ohranja pod enakimi zunanjimi pogoji.
Molekule v trdnem stanju so lahko v urejenem stanju, nato pa govorijo o kristalni strukturi. Ali pa so v neurejenem stanju, potem govorimo o amorfnih trdnih delcih. Izjemen primer kristalne rešetke je struktura kovinskih sistemov, ki v prostoru tvorijo idealno rešetko določenega tipa, v vozliščih katerih so ioni atomov. Primer trdnega predmeta z amorfno strukturo je steklo.

Znanost o trdnih snoveh
Trdne snovi študirajo več znanosti, ki vključujejo naslednje:
- Fizika kondenzirane snovi. Študira trdne in tekoče snovi, katerih dimenzije presegajo 10 19 delcev, z uporabo eksperimentalnih in teoretičnih metod.
- Mehanika deformacij. Ta znanost se preučuje mehanske lastnosti trdnih snovi kot so napetosti v njih, elastične in plastične deformacije ter povezava teh lastnosti s termodinamičnimi zunanjimi parametri. V tej disciplini je struktura najtežje snovi nepomembna.
- Znanost o materialih. Raziskuje strukturo molekul trdnih, tekočih in plinastih teles ter fazne prehode med njimi.
- Kemija trdnega stanja. Ta disciplina je specializirana za sintezo novih materialov v trdnem stanju.
Nekatere lastnosti trdnih snovi
Pri konstantnem tlaku in relativno nizkih temperaturah je snov v trdnem stanju. Učinek majhne zunanje sile na trdno stanje ne vodi do zunanje vidne deformacije trdne snovi.
Če povečate silo, se bo telo začelo elastično deformirati. S še večjim povečanjem zunanje izpostavljenosti sta možni dve možnosti:
- Če je telo kovina, se bo začela pojavljati plastična deformacija, kar pomeni, da se bodo pojavile pomembne spremembe v njeni obliki, ki bodo ostale po prenehanju zunanjega vpliva.
- Če ima telo amorfno strukturo ali kristalinično strukturo, vendar bodo v mrežnih mestih prisotni ioni različnih znakov, na primer kristali soli NaCl, potem se telo plastično ne deformira, ampak se preprosto zlomi.
Za vsako trdno telo je značilna določena gostota. Najlažja snov v tej kategoriji je zračni gel, njegova gostota je 3 kg / m 3 . Toda najbolj gosta trdna snov, ki je človeštvu znana, je kovina - osmij. Osem metrov kubičnih osmij ima maso 22.600 kg.
Kovinski materiali
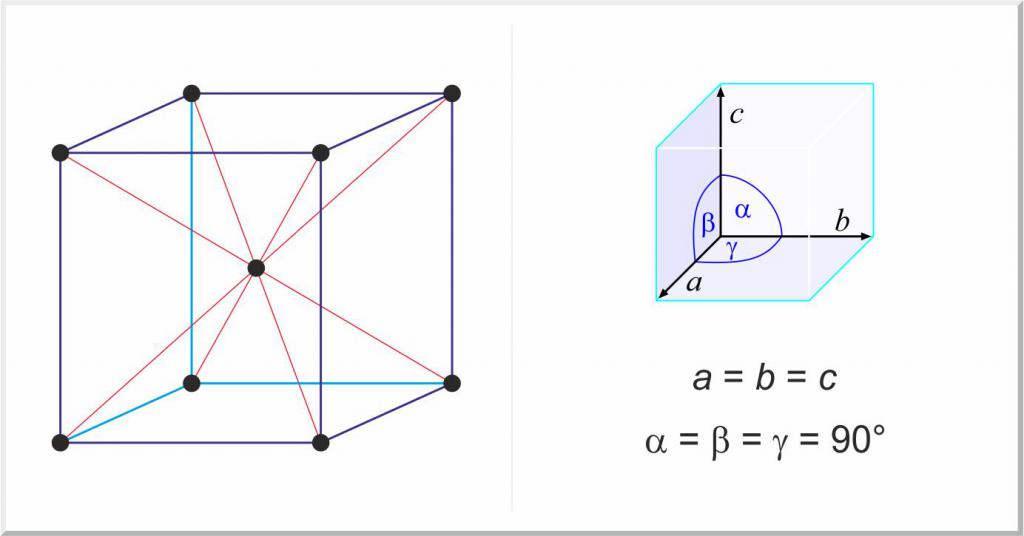
Posebna skupina trdnih snovi so čiste kovine in njihove zlitine. V tem primeru je razlika v strukturi trdnih snovi iz plinastih in tekočih stanj snovi v obstoju prostorske periodične mreže, ki se imenuje kristalna rešetka.

Zaradi svoje kristalne strukture imajo kovine številne pomembne lastnosti, na primer plastičnost in difrakcijo. Skoraj vse so v treh glavnih kristalnih mrežah:
- kubični sredinski obraz, npr. Au, Ag, Al, Cu;
- kubični, osredotočen na telo, na primer Nb, Mo, W, Fe;
- Šestkotno tesno zapakirano, na primer Ti, Zr.
Znanost o kristalografiji je bila razvita za preučevanje značilnosti kristalnih mrež.
Kondenzirana snov - tekočina
Tekoče stanje kot tudi trdno stanje je nestisljivo, kar pomeni, da ohranja svojo prostornino v precejšnjem območju pritiskov. Vendar pa tekočina ne ohrani svoje oblike, kar jo ločuje od trdne snovi in jo približuje plinskemu stanju snovi.

Če molekularne in atomske sile delujejo v nastajanju trdnih snovi, se tekočina tvori z molekulami, ki so med seboj povezane le z molekulskimi silami. Najpogostejša na Zemlji je voda, ki ima lahko, tako kot plin, obliko posode, v katero je nameščena.
Če govorimo o strukturi plinastih, tekočih in trdnih teles, je treba omeniti, da tekočina, za razliko od plina, ne spremeni svoje gostote, ko je postavljena v zaprto posodo.
Lastnosti, specifične za tekočino
Za vsako tekočino, zaradi prisotnosti molekulskih sil v njej, so lastnosti, kot so površinska napetost in kapilarni učinek. Če je snov na področju gravitacije, na primer, naše Zemlje, potem bo vsako telo, ki je v njej, potisnjeno iz tekočine v skladu z znamenitim Arhimedovim zakonom.

Če gravitacija ne deluje na tekočino, bo plavajoča sila nič. Poleg tega v odsotnosti zunanjih sil snovi v takem stanju nagiba k pridobitvi najmanjše površine, s čimer se zmanjša skupna energija. Zato so v pogojih breztežnosti vodne kapljice sferične oblike, saj je krogla številka z najmanjšo površino za to prostornino tekočine.
Kapilarne lastnosti se razlagajo s sposobnostjo molekul, da vstopajo v odnose ne le med seboj, ampak tudi z atomi in molekulami drugih teles. Te fizikalne lastnosti tekočin se imenujejo kohezija oziroma adhezija.
Na kratko o strukturi plinastih, tekočih in trdnih teles moramo omeniti lastnost viskoznosti, ki je značilna za tekoče in plinasto stanje. Viskoznost je zmožnost upreti vsakemu premiku plasti snovi v prisotnosti gradienta tlaka. Za tekočine je ta indikator odvisen od hitrosti premikanja teh plasti, temperature in molekulske mase. Višja kot je hitrost telesa v tekočini, večja je molekulska masa delcev tekočine in nižja je temperatura, višja je viskoznost.
Struktura plina
Plin je stanje materije, ko njegovi sestavni delci niso povezani z nobeno drugo silo ali pa so te sile zelo šibke. Zato takšne snovi prosto spreminjajo volumen in obliko, zapolnijo celotno posodo, v katero so nameščene. Ta razlika v strukturi plinastih teles od tekočine in trdne snovi vodi do manjše gostote. V primeru plinaste vode je običajno govoriti o pari.

Absolutne motnje v realnih plinih ni. Vendar se molekule v njem premikajo tako hitro, da praktično ne delujejo med seboj. Torej, plin zapolni absolutno vsak volumen in molekule v njem bodo ločene z relativno velikimi razdaljami v primerjavi z velikostjo samih molekul. Zaradi velike razdalje med molekulami se plini zlahka stisnejo, hkrati pa povečajo njihovo gostoto in notranji tlak.
Popoln plin
V fiziki, z ustvarjanjem modelov strukture trdnih, tekočih in plinastih teles, se pojavijo nekatere razumne poenostavitve resničnih stanj materiala, ki omogočajo uporabo enostavnejšega matematičnega aparata za preučevanje teh stanj. Eden od takšnih modelov je bil koncept idealnega plina.
Ta izraz se nanaša na plinasto stanje snovi, v kateri imajo molekule točkovne velikosti v primerjavi z razdaljami med njimi in v katerih medsebojno ne delujejo.
V normalnih pogojih, to je pri atmosferskem tlaku in sobni temperaturi, lahko večino pravega plina štejemo za idealne. Na primer dušik, kisik, vodik, žlahtni plini, ogljikov dioksid in drugi.
Enačba stanja za idealni plin je naslednja:
P * V = n * R * T, kjer:
P, V, T in n - tlak, prostornina, temperatura in količina snovi v plinu
R = 8,31 J / (mol * K) je univerzalna konstanta.
Plazma je četrto stanje snovi
Pri strukturi plinastih, tekočih in trdnih teles v 10. razredu so pozorni tudi na drugo stanje snovi - plazmo, ki je plin, sestavljen iz kationov in anionov, to je pozitivno in negativno nabitih delcev. Glavni primer plazme je snov, ki sestavlja naše sonce.
Za številne lastnosti je plazma podobna plinu, edina razlika je, da je sposobna reagirati na magnetna polja, kot tudi voditi električni tok. Plazmo lahko dobimo s segrevanjem plina do visokih temperatur, saj to povzroča trčenje med molekulami, kar vodi do njihove delne ali popolne ionizacije.
Sprememba stanja snovi
V fiziki razreda 10 se struktura plinastih, trdnih in tekočih teles obravnava skupaj s prehodi med temi stanjami. Prehodi med stanji snovi so možni zaradi sprememb v tlaku in temperaturi. Spremembe se pojavljajo le v fizični strukturi plinastih, tekočih in trdnih teles, njihova kemijska sestava pa ostaja konstantna.
Možni so naslednji prehodi med različnimi stanjami snovi:
- Taljenje Endotermični proces prehoda iz trdne v tekočino.
- Kristalizacija. Eksotermni postopek, pri katerem tekočina med hlajenjem postane trdna snov.
- Kuhaj. Fizični endotermni postopek, pri katerem tekočina vstopa v plin.
- Kondenzacija Eksotermni prehod plina v tekočino.
- Sublimacija ali sublimacija. Endotermični prehod iz trdnega v plin, mimo tekočega stanja. Klasičen primer je sublimacija suhega ledu.
Opozoriti je treba, da vsi endotermni in eksotermni procesi faznih prehodov potekajo s konstantno temperaturo snovi. Vsi ti procesi, katerih obstoj je posledica posebnosti strukture plinastih, tekočih in trdnih teles, so energetski, torej zahtevajo bodisi dobavo bodisi odstranitev energije med njihovim izvajanjem.