Relativna atomska masa elementa v kemiji in zgodovina njegove definicije
V procesu razvoja znanosti se je kemija soočila s problemom izračuna količine snovi za izvedbo reakcij in snovi, pridobljenih v njihovem poteku.
Danes je za takšne izračune kemijske reakcije med snovmi in zmesmi uporabljena vrednost relativne atomske mase, ki je navedena v periodni tabeli kemijskih elementov DI Mendeleev.
Kemijski procesi in vpliv deleža elementa v snovi na potek reakcije
Moderna znanost pod definicijo "relativne atomske mase kemijskega elementa" pomeni, kolikokrat je masa atoma določenega kemičnega elementa več kot ena dvanajstina ogljikovega atoma.
Z rojstvom kemije se je povečala potreba po natančnih definicijah poteka kemijske reakcije in njenih rezultatov. 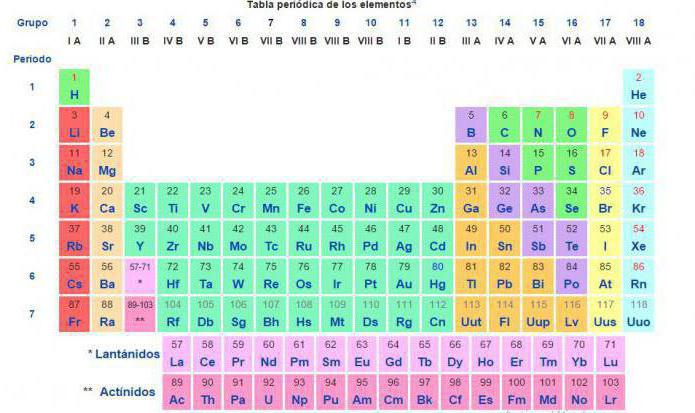 Zato so kemiki nenehno poskušali rešiti problem natančnih mas interakcijskih elementov v snovi. Ena najboljših takratnih odločitev je bila zavezujoča za najlažji element. Teža atoma je bila vzeta kot enota.
Zato so kemiki nenehno poskušali rešiti problem natančnih mas interakcijskih elementov v snovi. Ena najboljših takratnih odločitev je bila zavezujoča za najlažji element. Teža atoma je bila vzeta kot enota.
Zgodovinski potek štetja snovi
Sprva je bil uporabljen vodik, nato kisik. Toda ta metoda izračuna je bila netočna. Razlog za to je bila prisotnost izotopov z maso 17 in 18 v kisiku.
 Torej, ki imajo mešanico izotopov, je tehnično prejela številko, ki ni šestnajst. Trenutno je relativna atomska masa elementa izračunana na podlagi teže ogljikovega atoma, vzete kot osnova, v razmerju 1/12.
Torej, ki imajo mešanico izotopov, je tehnično prejela številko, ki ni šestnajst. Trenutno je relativna atomska masa elementa izračunana na podlagi teže ogljikovega atoma, vzete kot osnova, v razmerju 1/12.
Dalton je postavil temelje za relativno atomsko maso elementa
Le nekaj časa kasneje, v 19. stoletju, je Dalton predlagal izračun najlažjega kemičnega elementa, vodika. Na predavanjih za svoje učence je pokazal na izrezljane iz lesa, kako so atomi povezani. Za druge elemente je uporabil podatke, ki so jih prej pridobili drugi znanstveniki.
V skladu z Lavoisierjevimi poskusi voda vsebuje petnajst odstotkov vodika in oseminpetdeset odstotkov kisika. S temi podatki je Dalton izračunal, da je relativna atomska masa elementa, ki je del vode, v tem primeru kisika, 5,67. Napačnost njegovih izračunov je posledica dejstva, da je menil, da je napačen glede števila vodikovih atomov v vodni molekuli.
Po njegovem mnenju na atom kisika obstaja en atom vodika. Z uporabo podatkov kemika Austina, da je v sestavi amoniaka 20 odstotkov vodika in 80 odstotkov dušika, je izračunal, kakšna je relativna atomska masa dušika. S tem rezultatom je prišel do zanimivega zaključka. Izkazalo se je, da je relativna atomska masa (formula amoniaka pomotoma sprejeta z eno molekulo vodika in dušika) štiri. V svojih izračunih se je znanstvenik opiral na periodni sistem Mendelejeva. V skladu z analizo je izračunal, da je relativna atomska masa ogljika 4,4, namesto prej sprejetih dvanajst.
 Kljub resnim neuspehom je Dalton prvi ustvaril tabelo nekaterih elementov. V življenju znanstvenika se je večkrat spreminjala.
Kljub resnim neuspehom je Dalton prvi ustvaril tabelo nekaterih elementov. V življenju znanstvenika se je večkrat spreminjala.
Izotopska komponenta snovi vpliva na točnost relativne atomske teže
Ob upoštevanju atomskih mas elementov je mogoče ugotoviti, da je natančnost vsakega elementa drugačna. Na primer, v litiju je štirimestna, v fluor pa osemmestna. 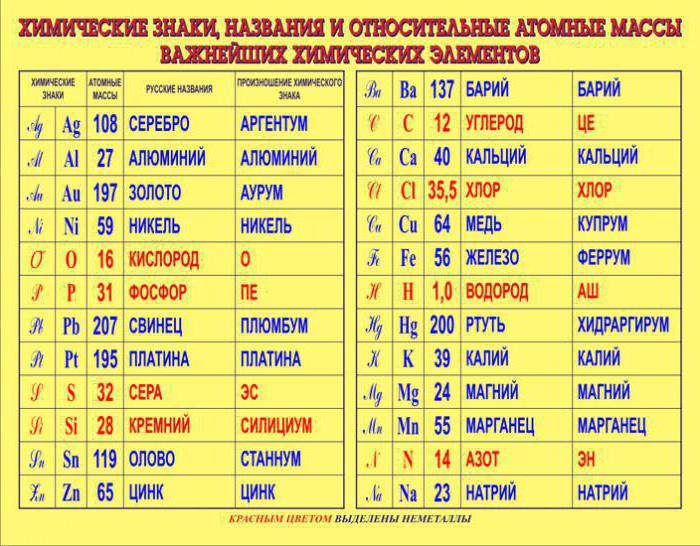 Problem je, da je izotopska komponenta vsakega elementa lastna in nestalna. Na primer, v navadni vodi obstajajo tri vrste izotopa vodika. Ti poleg običajnega vodika vključujejo devterij in tritij.
Problem je, da je izotopska komponenta vsakega elementa lastna in nestalna. Na primer, v navadni vodi obstajajo tri vrste izotopa vodika. Ti poleg običajnega vodika vključujejo devterij in tritij.
Relativna atomska masa vodikovih izotopov je dva in tri. "Težka" voda (ki jo tvorijo devterij in tritij) izhlapi. Zato so v izparilnem stanju izotopi vode manjši kot v tekočem stanju.
Selektivnost živih organizmov do različnih izotopov
Živi organizmi imajo selektivno lastnost glede ogljika. Za gradnjo organskih molekul se uporablja ogljik z relativno atomsko maso dvanajst. Zato snovi organskega izvora kot tudi številni minerali, kot sta premog in olje, vsebujejo manj izotopske komponente kot anorganski materiali.
Mikroorganizmi, ki procesirajo in kopičijo žveplo, pustijo za seboj žveplov izotop 32. Na območjih, kjer bakterije ne obdelujejo, je delež izotopov žvepla 34, to je veliko več. Ravno na podlagi razmerja žvepla v kamninah v tleh geologi prihajajo do zaključka o naravi izvora plasti - ali je magmatska ali sedimentna.
Od vseh kemijskih elementov samo eden nima izotopov - fluor. Zato je njena relativna atomska masa bolj natančna kot drugi elementi.
Obstoj nestabilnih snovi v naravi
Nekateri elementi imajo relativno maso v oglatih oklepajih. Kot lahko vidite, so to elementi, ki se nahajajo po uranu. Dejstvo je, da nimajo stabilnih izotopov in se razpadajo z sproščanjem radioaktivnega sevanja. Zato je najbolj stabilen izotop naveden v oklepajih. 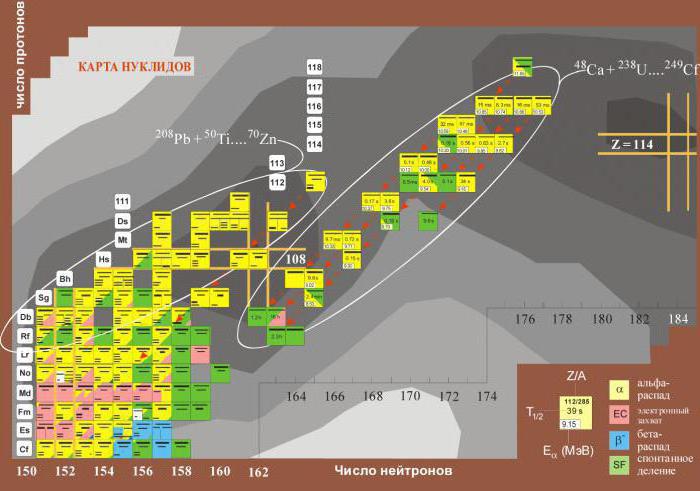 Sčasoma se je izkazalo, da imajo nekateri od njih stabilen izotop v umetnih pogojih. Potrebno je bilo spremeniti atomske mase nekaterih transuranskih elementov v periodnem sistemu Mendelejeva.
Sčasoma se je izkazalo, da imajo nekateri od njih stabilen izotop v umetnih pogojih. Potrebno je bilo spremeniti atomske mase nekaterih transuranskih elementov v periodnem sistemu Mendelejeva.
V procesu sinteze novih izotopov in merjenju njihove pričakovane življenjske dobe je bilo včasih mogoče odkriti nuklide s razpolovnim časom, ki je bil milijoni krat daljši.
Znanost ne stoji mirno, vedno se odkrivajo novi elementi, zakoni, medsebojne povezave različnih procesov v kemiji in naravi. Torej, v kakšni obliki se bo kemija in periodični sistem Mendeljejevih kemičnih elementov pojavila v prihodnosti, v sto letih od zdaj, je nejasna in negotova. Toda želim verjeti, da bodo dela kemikov, ki so se zbirala v zadnjih stoletjih, služila novemu, bolj popolnemu znanju naših potomcev.