Ogljikovodiki so spojine ogljika z vodikom, ki ne vsebujejo drugih elementov. Razvrstitev ogljikovodikov
Kaj so ogljikovodiki? Kako so razvrščeni? Katere funkcije imajo? Poskusimo skupaj poiskati odgovore na vprašanja.
Ogljikovodiki so organske spojine ki vsebujejo vodik in ogljik. So organske spojine v osnovni kemiji.
Razvrstitev
Glede na stanje vezi med ogljikom glavne verige je običajno vse C x H y razdeliti na več vrst. Posamezne ogljikove spojine z vodikom so značilne za nasičene ogljikovodike.
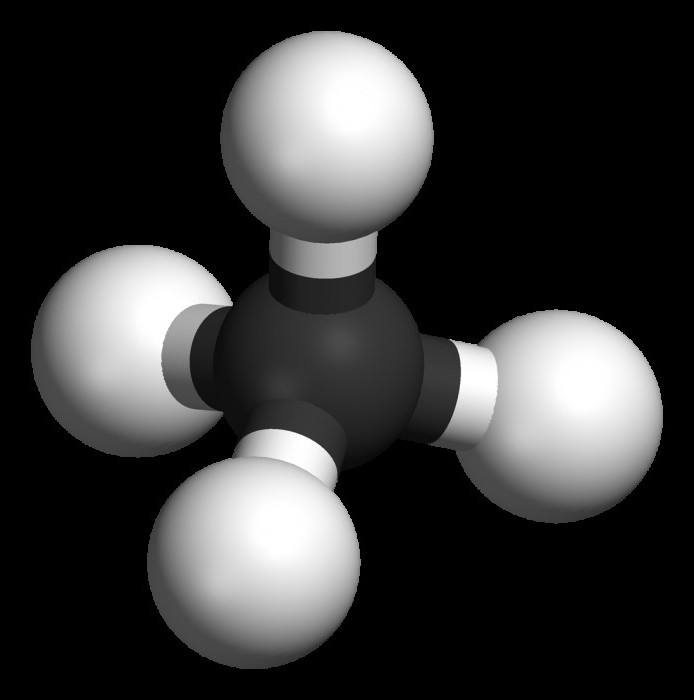
Alkani
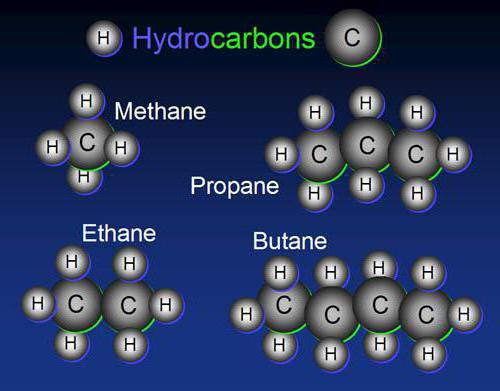
Mejni ogljikovodiki so spojine s splošno formulo CnH 2n + 2 . Med njihovimi značilnostmi lahko omenimo odsotnost zaprte strukture, pa tudi posamezne (preproste) vezi. V organski kemiji se imenujejo aciklične spojine.
Tipičen predstavnik tega razreda je metan - CH 4 . Prav on je tisti, ki začne homologno vrsto alkanov, ima vse lastnosti, ki so značilne za druge predstavnike parafinov.
Prvi predstavniki tega razreda ogljikovodikov so plinaste snovi z nizko topnostjo v vodi, poseben vonj.
Med osnovnimi kemijskimi lastnostmi, ki jih imajo predstavniki homolognih nizov alkanov, izločimo radikalno substitucijo.
Halogeniranje poteka pri povišanih temperaturah ali v prisotnosti ultravijoličnega sevanja. Reakcija poteka v več fazah, za katere je značilna postopna zamenjava vodikovih atomov s halogenom. Lastnosti ogljikovodikov številnih metanov so razložene z nasičenjem vezi med atomi ogljika. Ne morejo vstopiti v adicijske reakcije, medtem ko v kisiku iz zraka dobro gorijo in tvorijo ogljikov dioksid, vodne pare in sproščajo dovolj toplotne energije.
Med glavnimi vejami uporabe predstavnikov tega razreda ogljikovodikov smo izpostavili uporabo kot gorivo in možnost surovin za proizvodnjo številnih drugih organskih spojin.
Alkenes
Nenasičeni ogljikovodiki so spojine, ki imajo eno ali več večkratnih (nenasičenih) vezi med ogljikovimi atomi. Alkeni imajo splošno formulo CnH2n . Tipičen predstavnik tega razreda je etilen.
Ti naravni ogljikovodiki so del nafte. Glede na to, da molekula vsebuje dvojno vez, so za alkene značilne adicijske reakcije. Na primer, lahko vstopijo v halogenacijo, hidracijo.
Če se dvojna vez nahaja v prvem položaju, na primer v butenu-1, se dodaja vodikov halid in hidracija (reakcija z vodo) po Markovnikovem pravilu. Njegovo bistvo je v tem, da je med hidrohalogeniranjem in hidracijo vodik vezan na ogljikov atom, ki je z njim maksimalno nasičen.
Hidroksilna skupina ali atom halogena je vezana na atom C, ki ni nasičen z vodikom. Kvalitativna reakcija na nenasičeni (dvojni) vezi je beljenje vodne vode ali. t kalijev permanganat.

Cikloalkani
Takšni ogljikovodiki so ciklične spojine, ki so interklasni izomeri za alkenes. Imajo splošno formulo C n H 2n , posamezne vezi. Glede na to, da je za ta razred značilna zaprta struktura, vstopajo v reakcije adicije, ki jih spremlja uničenje zaprtega cikla, ki se spremeni v nasičene alkane. Glavni viri teh spojin so naravni in s tem povezani plin, nafta. Kljub ciklični strukturi, pri sp3 hibridizacijskih molekulah, je valenčni kot 109 ° 28 '.
Alkadiens
Kaj je še značilno za organsko kemijo? Ogljikovodiki tega razreda imajo splošno formulo CpH2n-2 . Vsi predstavniki dienskih ogljikovodikov imajo dve dvojni vezi. Nenasičenost dienov določa njihove osnovne kemijske lastnosti. Po analogiji z alkeni, dienske spojine vstopijo v adicijsko reakcijo.
Kot ti kemijske reakcije kar je značilno za te spojine, opažamo polimerizacijo. Začetni monomer v postopku je reprezentativen za diene, produkt interakcije pa sintetični kavčuk. Ko se doda žveplo v nastali polimer, pride do vulkanizacije, ki jo spremlja tvorba gume.
Alkine
Za te nenasičene organske spojine, za katere je značilna splošna formula CnH2n-2 , lahko opazimo prisotnost trojne vezi med ogljikovimi atomi. Če se nahaja po prvem atomu ogljika, je kvalitativna reakcija na njeno prisotnost nadomestitev s kompleksno spojino srebra.
Kot pri alkenih, dienih se alkini enostavno združijo v trojno vez. Za njih so značilni reakcije hidrogeniranja, hidrohalogeniranja, halogeniranja, hidracije.

Aromatične spojine
Benzen je prvi predstavnik tega razreda. Ima splošno formulo CnH 2n-6 . Za razliko od vseh drugih ogljikovodikov ima ta spojina aromatski obroč. V njenem nastajanju sodelujejo prosti elektroni vsakega ogljikovega atoma. Trije elektroni C tvorijo hibridne oblake, četrti elektron pa ne hibridizira. Oblikuje aromatski obroč, ki je enakomerno porazdeljen po molekuli. Enotna porazdelitev obroča s strukturo pojasnjuje njeno kemijsko stabilnost. Benzen sam vnese nadomestitev in dodatek le v težkih pogojih.
Za toluen, ki je njegov homolog, je značilen določen premik v elektronski gostoti, zato ima višjo sposobnost zamenjave. Ogljikovodikov radikal je usmerjevalnik tipa 1, prihajajoči substituenti (halogen, nitro skupina) zasedajo orto, para položaje.
Zaključek
Ne glede na to, katere značilnosti strukture so različni predstavniki ogljikovodikov, imajo določeno število ogljikovih atomov in vodikov v svoji sestavi. Obstaja določena težnja po spremembi fizikalnih lastnosti C x H y predstavnikov. Prvi predstavniki kateregakoli razreda imajo plinasto stanje, ko se relativna molekulska masa poveča, opazimo sistematičen prehod v tekočini, nato v trdni obliki.