Kaj je ogljik? Opis, lastnosti in formula ogljika
Na kratko govorimo o tem, kaj je ogljik nemogoče. Navsezadnje je on osnova življenja. Ta element je prisoten v vseh organskih spojinah in samo lahko tvori molekule DNA iz milijonov atomov. Njegove lastnosti so številne, zato je vredno o tem podrobneje povedati.
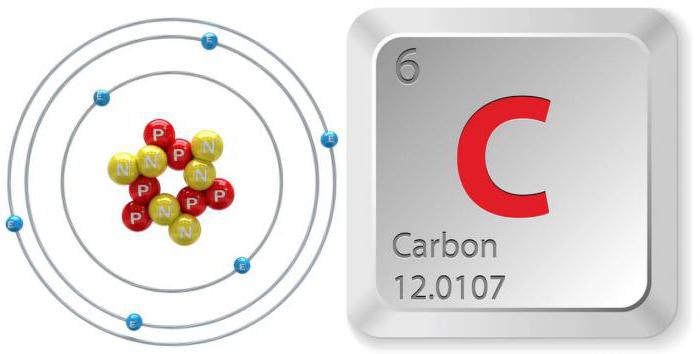
Formula, zapis, funkcije
Ta element, ki se nahaja v tabeli pod številko šest, je označen s simbolom "C". Elektronska strukturna formula ogljika je naslednja: 1s 2 2s 2 2p 2 . Njegova masa je 12,0107 amu. Ta snov ima:
- Dva neparna elektrona v osnovnem stanju. Prikazuje valenco II.
- Štirje neparni elektroni v vzbujenem stanju. Prikazuje valenco IV.
Treba je opozoriti, da je v Zemljini skorji določena masa ogljika. Natančneje, 0,023%. Večinoma se nabira v zgornjem delu, v biosferi. Večina mase ogljika v litosferi se nabira v dolomitih in apnencih v obliki karbonatov.
Fizične lastnosti
Kaj je torej ogljik? To je snov, ki obstaja v velikem številu alotropnih modifikacij in njihove fizikalne lastnosti se lahko navedejo že dolgo časa. Različne snovi so posledica sposobnosti ogljika, da tvori kemijske vezi različnih vrst.
Kaj pa lastnosti ogljika kot preproste snovi? Lahko jih povzamemo, kot sledi:
- V normalnih pogojih je gostota 2,25 g / cm3.
- Vrelišče je 3506,85 ° C.
- Molarna toplotna kapaciteta je 8,54 J / (K • mol).
- Temperatura kritičnega faznega prehoda (kadar plin ne kondenzira pri nobenem tlaku) je 4130 K, 12 MPa.
- Molarni volumen 5,3 cm3 / mol.
Prav tako je vredno navesti spremembe ogljika.
Med kristaliničnimi snovmi so najbolj znani: diamant, karbin, grafit, nano-diamant, polimer, londdaleit, fuleren in ogljikova vlakna.
Amorfne formacije vključujejo les, fosil in aktivni ogljik, antracit, koks, stekleni ogljik, saje, saje in nanopene.
Vendar nobeno od zgoraj navedenih ni čista alotropna oblika obravnavane snovi. To so le kemične spojine, v katerih je ogljik v visoki koncentraciji.

Struktura
Zanimivo je, da elektronske orbitale ogljikovega atoma niso enake. Imajo različno geometrijo. Vse je odvisno od stopnje hibridizacije. Obstajajo tri najpogostejše geometrije:
- Tetraedarska . Nastane, ko pride do mešanice treh p- in enih s-elektronov. Ta geometrija ogljikovega atoma je opažena v lonsdaleitu in diamantu. Metan in drugi ogljikovodiki imajo podobno strukturo.
- Trigonal . Ta geometrija tvori mešanico dveh p- in enih s-elektronskih orbital. Drugi p-element ne sodeluje pri hibridizaciji, vendar je vključen v tvorbo π-vezi z drugimi atomi. Ta struktura je značilna za fenol, grafit in druge modifikacije.
- Digonal . Ta struktura nastane zaradi mešanja s- in p-elektronov (enega za drugim). Zanimivo je, kakšni so elektronski oblaki kot asimetrične dumbbelle. Raztegnili so se ob njeni smeri. Dva več p-elektronov tvorita notorne π-vezi. Ta geometrija je značilna za carbyne.
Ne tako dolgo nazaj, leta 2010, so znanstveniki z univerze, ki se nahaja v Nottinghamu, odkrili spojino, v kateri so bili štirje atomi naenkrat v isti ravnini. Njegovo ime je Monomeric Dilitio Methanium.
Molekule
O njih je treba reči ločeno. Pridružijo se lahko atomi obravnavane snovi, kar povzroči nastanek kompleksnih ogljikovih molekul. Od nasičenih Na, S 2 in N 2 , med katerimi je privlačnost prešibka, jih odlikuje težnja k kondenzaciji v trdno stanje. Karbonske molekule lahko ostanejo v plinastem stanju samo, če vzdržujete visoko temperaturo. Sicer se snov takoj strdi.
Nekaj časa nazaj je bila v Združenih državah v Nacionalnem laboratoriju Berkleev sintetizirana nova oblika trdnega ogljika. To je C36. In njegova molekula tvori 36 atomov ogljika. Snov se tvori skupaj s fulereni C60. To se zgodi med dvema grafitne elektrode, v pogojih plamena razelektritve obloka. Znanstveniki kažejo, da imajo molekule nove snovi zanimive kemijsko-električne lastnosti, ki še niso bile preučene.

Grafit
Zdaj lahko podrobneje poveste o najbolj znanih spremembah snovi, kot je ogljik.
Grafit je naravni mineral z večplastno strukturo. Tu so njene značilnosti:
- On je odličen dirigent.
- Je relativno mehka snov zaradi svoje majhne trdote.
- Pri segrevanju v odsotnosti zraka je odporen.
- Ne topi se.
- Na dotik maščobe, spolzke.
- V naravnem grafitu vsebuje 10-12% nečistoč. Praviloma so to železovi in glineni oksidi.
Če govorimo o kemijskih lastnostih, je treba omeniti, da s solmi in alkalijske kovine ta snov tvori ti inkluzijske spojine. Tudi grafit pri visokih temperaturah reagira s kisikom in sežge ogljikov dioksid. Toda stik z neoksidirajočimi kislinami ne prinaša nobenega rezultata - ta snov se preprosto ne raztopi v njih.
Uporabite grafit v najrazličnejših sferah. Uporablja se pri izdelavi obložnih plošč in talilnih loncev, pri proizvodnji grelnih elementov in elektrod. Brez sodelovanja grafita je nemogoče pridobiti sintetične diamante. Prav tako igra vlogo moderatorja nevtronov v jedrskih reaktorjih. In seveda so palice za svinčnike izdelane iz nje, kar ovira kaolin. In to je le del področij, kjer se uporablja.

Diamond
Je metastabilni mineral, ki lahko obstaja neomejeno časovno obdobje, kar je do neke mere posledica moči in gostote ogljika. Diamond je najtežja snov po Mohsovi lestvici, zlahka seka steklo.
Ima visoko toplotno prevodnost, disperzijo, lomni količnik. Trajen je in za to, da se tali, potrebujete temperaturo 4000 ° C in tlak okoli 11 GPa. Njegova značilnost je luminiscenca, sposobnost sijanja v različnih barvah.
To je redka, čeprav skupna snov. Starost mineralov se po nekaterih študijah giblje od 100 do 2,5 milijard let. Najdeni diamanti izvenzemeljskega izvora, morda celo pred soncem.
Ta mineral je našel svojo uporabo v nakitu. Rezani diamant, imenovan diamant, je drag, vendar je zaradi njegovega statusa draguljev in lepote postal še bolj priljubljen. Mimogrede, ta snov se uporablja tudi pri izdelavi sekalcev, vrtalnikov, nožev itd. Zaradi svoje izjemne trdote se mineral uporablja v mnogih industrijskih panogah.

Carbin
Nadaljevanje teme o tem, kaj je ogljik, moramo povedati nekaj besed o njegovi spremembi, kot je karbin. Izgleda kot črni kristalni prah, ki ima lastnosti polprevodnikov. Sintetično pridobljeno v zgodnjih 60. letih sovjetskih znanstvenikov.
Posebnost te snovi je povečana prevodnost pod svetlobnim učinkom. Zato se je začel uporabljati v fotovoltaičnih celicah.

Grafen
To je prvi dvodimenzionalni kristal na svetu. Ta sprememba ima večjo mehansko togost kot grafit in visoko rekordno toplotno prevodnost, ki je ~ 5 • 10 3 W • m −1 • K -. Nosilci grafena imajo visoko mobilnost, zato ima snov možnosti za njeno uporabo v različnih aplikacijah. Menijo, da lahko postane prihodnja osnova nanoelektronike in celo zamenja silicij v integriranih vezjih.
Grafen se pridobiva umetno v znanstvenih laboratorijih. Pri tem je treba uporabiti mehansko ločevanje grafitnih plasti od visoko usmerjene snovi. Tako dobite kakovostne vzorce s potrebno mobilnostjo prevoznikov.
Njegove lastnosti niso bile v celoti raziskane, vendar so znanstveniki že opazili nekaj zanimivega. V grafenu na primer ni kristalizacije Wingerja. V dvojni plasti materije je obnašanje elektronov podobno tisti, ki je značilna za tekoče kristale. Če opazujemo delitvene parametre na kristalu, bomo uspeli pridobiti grafensko podobne nanostrukture.

Strupenost
Ta tema je vredno omeniti v zaključku zgodbe o tem, kaj je ogljik. Dejstvo je, da se ta snov sprošča v ozračje skupaj z izpušnimi plini iz avtomobilov. In tudi pri sežiganju premoga, podzemnem uplinjanju in v mnogih drugih procesih.
Povečana vsebnost te snovi v zraku vodi do povečanja števila bolezni. To še posebej velja za pljuča in zgornja dihala. Toda toksični učinek je posledica interakcije sevalne narave z β-delci, kar vodi k dejstvu, da se kemijska sestava molekule spreminja in lastnosti snovi - preveč.