Planetarni model atoma: Rutherfordova izkušnja
Planetarni model atoma je predlagal E. Rutherford leta 1910. Prve študije o strukturi atoma so bile izvedene s pomočjo alfa delcev. Na podlagi rezultatov, pridobljenih v poskusih o njihovem razprševanju, je Rutherford predlagal, da je celoten pozitivni naboj atoma koncentriran v drobnem jedru v njegovem središču. Po drugi strani pa so negativno nabiti elektroni porazdeljeni znotraj preostalega volumna.
Malo ozadja
Prvo briljantno domnevo o obstoju atomov je naredil starogrški znanstvenik Demokrit. Od takrat ideja o obstoju atomov, katere kombinacije dajejo vse snovi okoli nas, ni zapustila domišljije ljudi znanosti. Občasno so jo obravnavali različni predstavniki, vendar so bile njihove konstrukcije do začetka 19. stoletja zgolj hipoteze, ki jih eksperimentalni podatki ne podpirajo.
Nazadnje, leta 1804, več kot sto let, preden se je pojavil planetarni model atoma, je angleški znanstvenik John Dalton predstavil dokaz svojega obstoja in uvedel koncept atomske teže, kar je bila njena prva kvantitativna značilnost. Tako kot njegovi predhodniki je predstavljal atome v najmanjših delih snovi, kot so trdne kroglice, ki jih ni bilo mogoče razdeliti na še manjše delce.
Elektronsko odkritje in prvi model atoma
Skoraj stoletje je minilo, ko je končno, konec 19. stoletja, Anglež JJ Thomson odkril tudi prvi subatomski delček, negativno nabiti elektron. Ker so atomi električno nevtralni, je Thomson mislil, da morajo biti sestavljeni iz pozitivno nabitega jedra z elektroni, raztresenimi po celotnem volumnu. Na podlagi različnih eksperimentalno pridobljenih rezultatov je leta 1898 predlagal svoj model atoma, včasih imenovan "slive v pudingu", ker je bil atom v njem predstavljen kot krogla, napolnjena z nekaj pozitivno nabite tekočine, v kateri so bili elektroni vstavljeni kot "slive" v pudingu. " Polmer takšnega sferičnega modela je bil približno 10 -8 cm, skupni pozitivni naboj tekočine pa je simetrično in enakomerno uravnotežen elektronski naboji, kot je prikazano na spodnji sliki. 
Ta model je zadovoljivo razložil dejstvo, da se pri segrevanju snovi začne svetiti. Čeprav je bil to prvi poskus razumeti, kaj je atom, ne more zadovoljiti rezultatov poskusov, ki so jih kasneje izvedli Rutherford in drugi. Thomson leta 1911 se je strinjal, da njegov model preprosto ne more odgovoriti na vprašanje, kako in zakaj se pojavijo α-ray razpršitve, opažene pri poskusih. Zato je bila opuščena, nadomeščen pa je bil popolnejši planetarni model atoma.
Kako je atom enak?
Ernest Rutherford je pojasnil pojav radioaktivnosti, ki mu je prinesel Nobelovo nagrado, toda njegov najpomembnejši prispevek k znanosti je nastal pozneje, ko je ugotovil, da atom sestavlja gosto jedro, obkroženo z elektronskimi orbitami, tako kot Sonce obkroža orbite planetov. 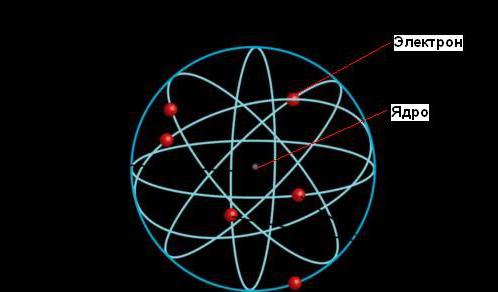
Glede na planetarni model atoma je večina njegove mase skoncentrirana v drobnem jedru (v primerjavi z velikostjo celotnega atoma). Elektroni se gibljejo okoli jedra, potujejo z neverjetno hitrostjo, vendar je večina volumna atomov prazen prostor.
Velikost jedra je tako majhna, da je njen premer 100.000-krat manjši od atoma. Rutherford je premer jedra ocenil kot 10 -13 cm, za razliko od velikosti atoma 10-8 cm, zunaj jedra pa se elektroni vrtijo okoli njega pri visokih hitrostih, kar povzroči centrifugalne sile, ki uravnavajo elektrostatične sile privlačnosti med protoni in elektroni.
Rutherfordove izkušnje
Planetarni model atoma je nastal leta 1911, po slavnem eksperimentu z zlato folijo, kar nam je omogočilo pridobiti nekaj temeljnih informacij o njegovi strukturi. Rutherfordova pot do odkritja atomskega jedra je dober primer vloge ustvarjalnosti v znanosti. Njegovo iskanje se je začelo leta 1899, ko je odkril, da nekateri elementi oddajajo pozitivno nabite delce, ki lahko prodrejo karkoli. Te delce je imenoval alfa (α) delce (zdaj vemo, da so to jedra helija). Kot vsi dobri znanstveniki je bil Rutherford radoveden. Spraševal se je, ali se alfa delci lahko uporabijo za ugotavljanje strukture atoma. Rutherford se je odločil usmeriti žarek alfa delcev na list zelo tanke zlate folije. Izbral je zlato, ker ga lahko uporabimo za izdelavo listov tako majhnih kot 0,00004 cm, za list zlate folije pa je postavil zaslon, ki je zasvetil, ko so ga udarili alfa delci. Uporabili smo ga za zaznavanje alfa delcev, ko so šli skozi folijo. Majhna reža na zaslonu je omogočila, da je žarek alfa delcev dosegel folijo po izhodu iz vira. Nekateri od njih naj bi šli skozi folijo in se še naprej gibali v isti smeri, drugi del pa bi se moral odbiti od folije in se odbiti v ostrih kotih. Diagram poskusov si lahko ogledate na spodnji sliki. 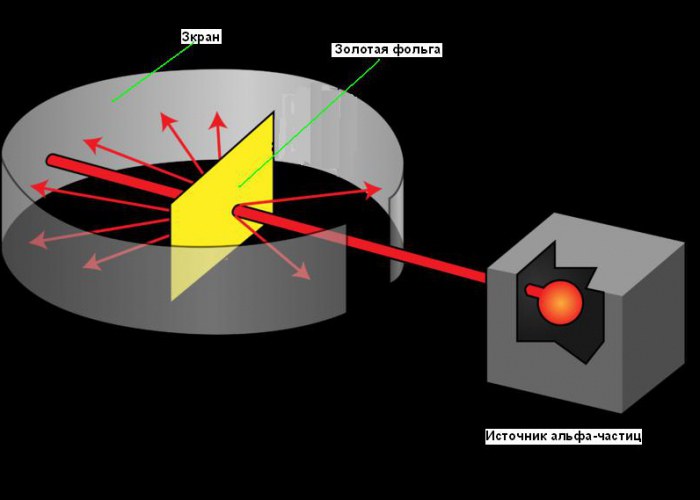
Kaj se je zgodilo v izkušnji Rutherforda?
Na podlagi JJ Thomsonovega modela atoma je Rutherford predlagal, da bi področja trdnih pozitivnih nabojev, ki bi zapolnila celoten volumen atomov zlata, upogibala ali upogibala trajektorije vseh alfa delcev, ko so šli skozi folijo.
Velika večina alfa delcev pa je šla skozi zlato folijo, kot da ne obstaja. Zdelo se je, da so šli skozi prazen prostor. Le malo jih odstopa od ravne poti, kot je bilo predvideno na začetku. Spodaj je prikazan graf števila delcev, razpršenih v ustrezni smeri na kotu sipanja. 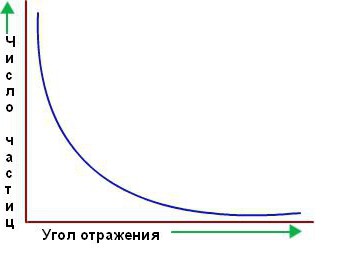
Presenetljivo se je iz folije vrnil majhen odstotek delcev, ko se je košarka odbijala od ščita. Rutherford je ugotovil, da so ta odstopanja posledica neposrednega trka alfa delcev in pozitivno nabitih komponent atoma.
Jedro je osrednje mesto
Na podlagi neznatnega odstotka alfa delcev, ki se odbijajo od folije, lahko sklepamo, da je celoten pozitivni naboj in skoraj celotna masa atoma koncentrirana v enem majhnem prostoru, preostali del pa je večinoma prazen prostor. Rutherford je območje koncentriranega pozitivnega naboja imenoval jedro. Napovedal je in kmalu odkril, da vsebuje pozitivno nabite delce, ki jih je imenoval protone. Rutherford je napovedal obstoj nevtralnih atomskih delcev, imenovanih nevtroni, vendar jih ni mogel zaznati. Kljub temu jih je nekaj let pozneje odkril njegov študent James Chadwick. Spodnja slika prikazuje strukturo jedra atoma urana. 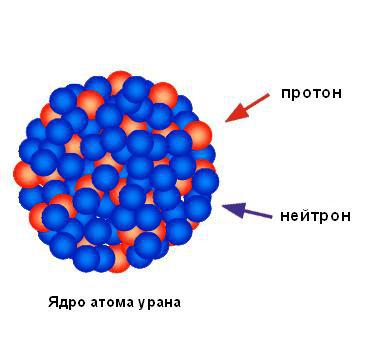
Atomi so sestavljeni iz pozitivno nabitih težkih jeder, obkroženih z negativno nabitimi izjemno lahkimi elektronskimi delci, ki se vrtijo okoli njih, in s tako hitrostjo, da mehanske centrifugalne sile preprosto uravnavajo elektrostatično privlačnost z jedrom in s tem v zvezi naj bi bila zagotovljena stabilnost atoma.
Slabosti tega modela
Glavna ideja Rutherforda je pripadala ideji majhnega atomskega jedra. Predpostavka elektronskih orbit je bila čista hipoteza. Ni natančno vedel, kje in kako se elektroni vrtijo okoli jedra. Zato planetarni model Rutherford ne pojasnjuje porazdelitve elektronov v orbitah.
Glavna ideja Rutherforda je pripadala ideji majhnega atomskega jedra. Predpostavka elektronskih orbit je bila čista hipoteza. Ni natančno vedel, kje in kako se elektroni vrtijo okoli jedra. Zato planetarni model Rutherford ne pojasnjuje porazdelitve elektronov v orbitah.
Poleg tega je bila stabilnost Rutherfordovega atoma mogoča le z neprekinjenim gibanjem elektronov v orbitah brez izgube kinetične energije. Toda elektrodinamični izračuni so pokazali, da gibanje elektronov vzdolž vseh krivuljnih trajektorij, ki ga spremlja sprememba smeri vektorja hitrosti in pojav ustreznega pospeška, neizogibno spremlja emisija elektromagnetne energije. Hkrati, v skladu z zakonom o ohranjanju energijo, kinetično energijo Elektron mora biti zelo hitro porabljen za sevanje in mora pasti na jedro, kot je shematsko prikazano na spodnji sliki. 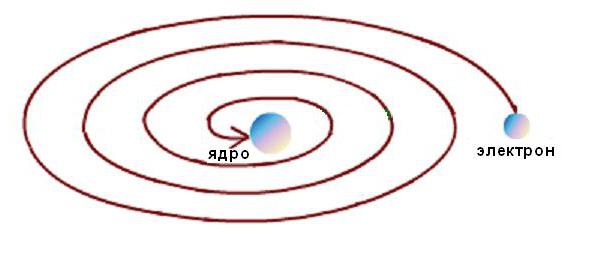 Vendar se to ne zgodi, ker so atomi stabilne formacije. Tipično za znanstveno protislovje je nastalo med modelom pojava in eksperimentalnimi podatki.
Vendar se to ne zgodi, ker so atomi stabilne formacije. Tipično za znanstveno protislovje je nastalo med modelom pojava in eksperimentalnimi podatki.
Od Rutherforda do Nielsa Bohra
Naslednji pomemben korak naprej v atomski zgodovini se je zgodil leta 1913, ko je danski znanstvenik Niels Bohr objavil opis podrobnejšega modela atoma. Jasneje je opredelila mesta, kjer se lahko nahajajo elektroni. Čeprav bodo kasneje znanstveniki razvili bolj izpopolnjene atomske strukture, je bil planetni model atomov Bohra v bistvu pravilen, veliko pa je še vedno sprejetih. Imela je veliko uporabnih aplikacij, na primer, s svojo pomočjo so razložili lastnosti različnih kemijskih elementov, naravo njihovega sevalnega spektra in strukturo atoma. Planetarni model in Borov model sta bila najpomembnejša mejnika, ki sta zaznamovala nastanek nove smeri v fiziki - fizike mikrosvijeta. Bohr je leta 1922 prejel Nobelovo nagrado za fiziko za svoj prispevek k razumevanju strukture atoma.
Kaj je novi Bohr prinesel atomskemu modelu?
Ko je bil še mlad, je Bohr delal v laboratoriju Rutherford v Angliji. Ker je bil koncept elektronov slabo razvit v Rutherfordovem modelu, se je Bohr osredotočil nanje. Posledično je bil planetni model atoma bistveno izboljšan. Bohrovi postulati, ki ga je oblikoval v članku »O strukturi atomov in molekul«, objavljenem leta 1913, navaja:
1. Elektroni se lahko gibljejo okoli jedra samo na določenih razdaljah od njega, kar je odvisno od količine energije, ki jo imajo. Te fiksne nivoje je imenoval energetske nivoje ali elektronske lupine. Bohr jih je predstavljal v obliki koncentričnih sfer, v središču vsakega od njih je jedro. V tem primeru se bodo elektroni z nižjo energijo našli na nižjih nivojih, bližje jedru. Tisti, ki imajo več energije, bodo najdeni na višjih ravneh, dlje od jedra.
2. Če elektron absorbira nekaj (precej specifično za dano raven) količino energije, potem bo skočil na naslednjo, višjo energetsko raven. Nasprotno, če izgubi enako količino energije, se bo vrnil na prvotno raven. Vendar pa elektron ne more obstajati na dveh ravneh energije.
Ta ideja je ponazorjena s sliko. 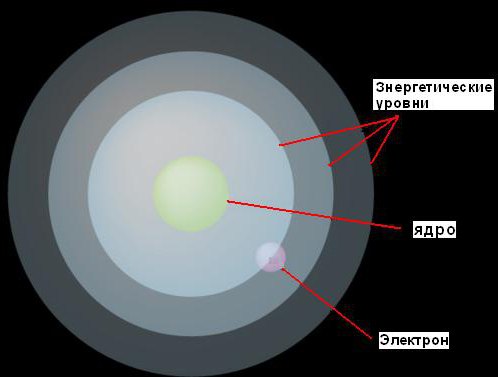
Energetski deli za elektrone
Model Bohrovih atomov je dejansko kombinacija dveh različnih idej: Rutherfordov atomski model z elektroni, ki se vrtijo okoli jedra (v resnici je planetarni model Borov - Rutherfordovega atoma), in ideja nemškega znanstvenika Maxa Plancka o kvantizaciji energije snovi, objavljeni leta 1901. Kvant (v množini, kvanti) je najmanjša količina energije, ki jo lahko absorbira ali izžareva snov. To je nekakšen korak vzorčenja količine energije.
Če energijo primerjate z vodo in jo želite dodati snovi v obliki kozarca, vode ne morete le polniti v neprekinjen tok. Namesto tega ga lahko dodate v majhnih količinah, na primer žličko. Bohr je verjel, da če elektroni lahko absorbirajo ali izgubijo le fiksne količine energije, potem morajo svojo energijo spreminjati le s temi fiksnimi količinami. Tako lahko zasedajo le fiksno energije okoli jedra, ki ustrezajo kvantiziranim prirastkom njihove energije.
Tako kvantni pristop k razlagi, kaj sestavlja atomska struktura, izhaja iz Bohrovega modela. Planetarni model in Borov model sta bila posebna koraka od klasične fizike do kvantne fizike, ki je glavno orodje v fiziki mikrosvijeta, vključno z atomsko fiziko.