Litijev hidroksid. Primeri kemijskih reakcij kot tudi fizikalne lastnosti alkalij in njegovih značilnosti
Kaj je litijev hidroksid? Ta spojina je ena najpomembnejših toplotno odpornih spojin, ki se uporabljajo v proizvodnji za pripravo različnih litijevih soli. Ioni tega elementa imajo številne značilne lastnosti, ki so našle široko uporabo v kemični proizvodnji.
Značilnosti strukture litijevega atoma
Litij (Li) je element skupine I glavne podskupine 2. obdobja in spada v skupino alkalijske kovine. Pogosto se imenuje prehod na zemeljsko alkalijske elemente, saj ima nekoliko manjšo aktivnost kot naslednji člani te skupine, na primer natrij (Na) ali kalij (K).
Litijev atom ima najmanjši polmer med vsemi alkalijskimi kovinami, kar povzroča njegovo kemično aktivnost. Posebno vlogo igra stabilna 1s 2 elektronska lupina tipa helija, ki je pred valentnim elektronom 2s 1 , kar ustvarja visoko polarizabilnost delca.
Ta lastnost litija je značilna za pojav elektromagnetnega ali dipolnega polja okoli atoma, ki omogoča ustvarjanje močnih kompleksnih ionov, kot je [Li (NH3) n ] + . Opozoriti je treba, da s temi lastnostmi sam atom ni podvržen polarizaciji, kar pojasnjuje toplotno nestabilnost nekaterih njegovih soli, zlasti pri kompleksnih anionih.
Vsa zgoraj navedena dejstva pojasnjujejo nekatere značilnosti fizikalnih in kemijskih lastnosti litijevega hidroksida (LiOH).

Fizične lastnosti
Čisti LiOH je zelo jedka snov, ki lahko uniči steklo in porcelan, zato se shrani v voskanih posodah. V staljenem stanju se lahko pridobiva le v nikeljskih ali srebrnih posodah, saj oksidira večino kovin in zlitin. Zlato je ena od redkih snovi, ki so odporne na učinke take spojine.
Sama baza, v primerjavi z oksidom Li 2 O, je kemično nestabilna in bližje 1000 ° C v atmosferi vodika, H 2 se razgradi v svoje sestavine (primer 1).
Litijev oksid in litijev hidroksid v kemično čistem stanju sta trdni snovi, relativno topni v vodi, vendar manj (skoraj petkrat) kot podobne spojine naslednjih članov skupine. Najvišja točka raztapljanja pri opisani bazi je pri 100 ° C - 17,5 g / 100 g topila, na primer pri natrijevem hidroksidu (NaOH) pa 337 g / 100 g in se še naprej povečuje s povišanjem temperature. Hkrati je topnost litijevega hidroksida skoraj 100-krat večja od topnosti gašenega apna (Ca (OH) 2 ), pri čemer se ta sposobnost zmanjšuje z naraščanjem temperature.
Zanimivo je bilo eksperimentalno možno pridobiti plinasti LiOH v prisotnosti vodne pare. Proizvaja se z ogrevanjem Li-oksida do 2000 ° C, ko se po mejniku 1000 ° C parni tlak te spojine poveča zaradi tvorbe stabilne starševske baze (primer 2).
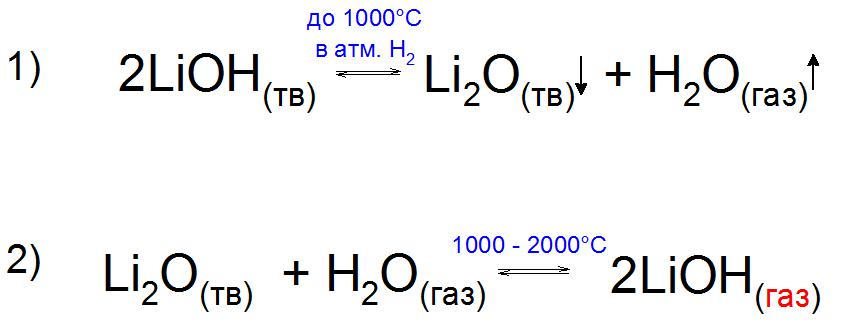
Kemijske lastnosti
Litijev hidroksid se ne šteje za kislino, ker ni amfoterni element in ne kaže zmožnosti razpadanja glede na vrsto MeOH O MeO - + H + (kjer je Me katerakoli kovina skupine I ali II glavne podskupine), kot drugi predstavniki alkalnih kovin. Za take spojine velja, da so zelo močne baze, saj je njihova disociacijska konstanta po principu MeOH + Me + + OH zelo visoka (Kb , LiOH = 6,75 · 10 -1 ).
Ker ima takšna spojina močne osnovne lastnosti, lahko vstopi nevtralizacijske reakcije s kislinami kislinskih oksidov in izmenjavo z različnimi solmi (primer 3).
Tipična reakcija je interakcija hladnih in vročih koncentriranih raztopin litijevega hidroksida s klorovim plinom, da nastanejo hipokloriti in litijevi klorati (primer 4).
Značilnost te baze je interakcija z vročo raztopino vodikovega peroksida H 2 O 2 z nastajanjem kristalnega hidrata litijevega peroksida Li 2 O 2 v etanolu, razdeljenega v vakuumu (primer 5).
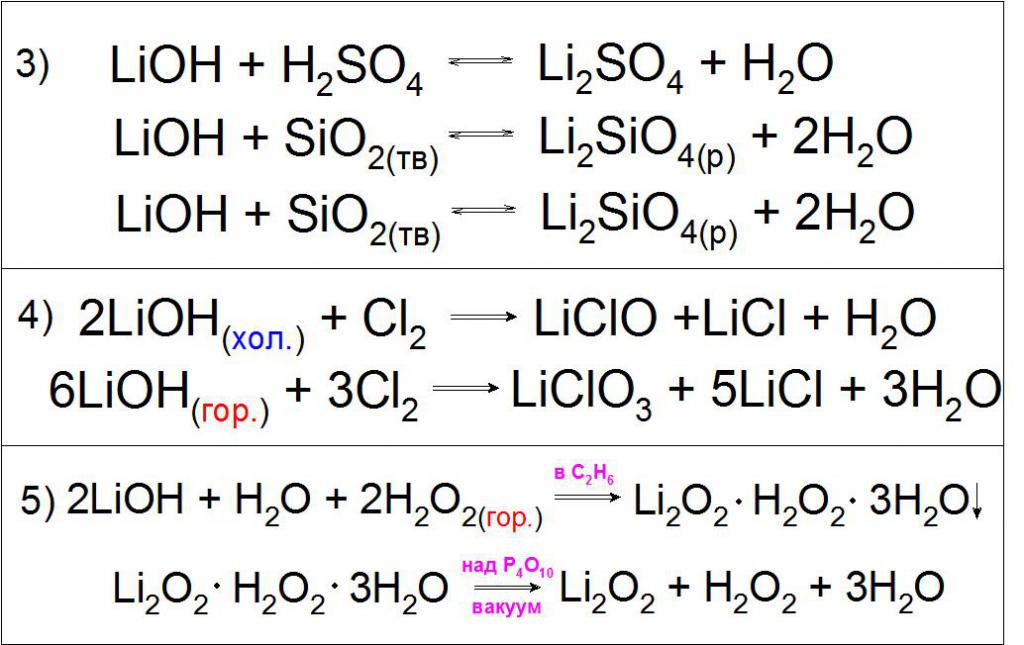
Pridobivanje
LiOH dobimo na različne načine, med katerimi je neposredna interakcija kovine ali njenega oksida z vodo po shemi litij → litijev oksid → litijev hidroksid.

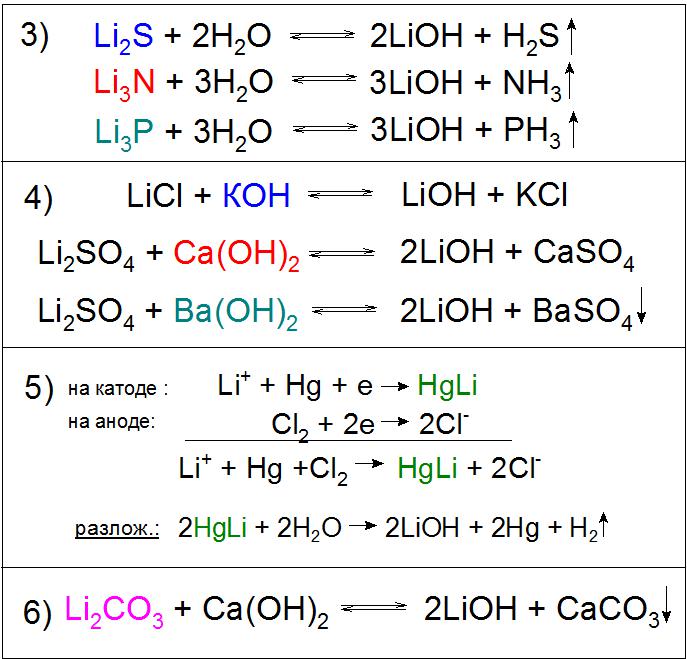
Uporabimo tudi hidrolizo sulfida, nitrida, fosfidov in drugih spojin (primer 3).
Reakcije izmenjave raztopin litijevih soli so možne s skoraj katerim koli razlogom, na primer kalijev hidroksid (KOH), kalcija (Ca (OH) 2 ) in barija (Ba (OH) 2 ) in pri zadnjem reagentu kemična interakcija skoraj popolnoma poteka z Li sulfatom. V prvem in drugem primeru bo reakcija upravičena zaradi slabe topnosti pridobljenih soli v raztopini LiOH (primer 4), v tretjem pa bo dodan vodotopni BaSO 4 (primer 4). Opozoriti je treba, da se ta možnost ne uporablja v proizvodnji iz ekonomskih razlogov.
Druga izjemna metoda pridobivanja te spojine je elektroliza raztopine litijevega klorida LiCl na katodi živega srebra. To proizvaja amalgam HgLi, zanimivo, ker je njegovo tališče veliko višje (609 ° C) kot katera koli njegova komponenta. V procesu razgradnje z vodo dobljene spojine se tvori potrebna baza (primer 5).
Poseben industrijski pomen je reakcija razgradnje litijevega karbonata z gašenim apnom, med katerim kemijsko ravnovesje umetno premaknjen na desno stran za višji donos glavnega proizvoda (primer 6).
Uporaba
Litijev hidroksid se uporablja za pripravo stearatov te kovine za proizvodnjo vodoodpornih mrazov in maziv, odpornih na vročino. Uporablja se tudi kot katalizator pri izdelavi polimernih materialov in kot sestavni del elektrolita v različnih baterijah.

V požarni in vojaški praksi se litijev hidroksid uporablja kot absorber ogljikovega dioksida (CO 2 ) v plinskih maskah.