Kemijsko ravnovesje in ustvarjanje pogojev za njegovo premikanje
Proučevanje parametrov sistema, vključno z izhodnimi materiali in reakcijskimi produkti, nam omogoča, da ugotovimo, kateri dejavniki premikajo kemično ravnovesje in vodijo do želenih sprememb. Na podlagi ugotovitev Le Chatelierja, Browna in drugih znanstvenikov o načinih izvajanja reverzibilnih reakcij, temeljijo industrijske tehnologije, ki omogočajo izvedbo prej navidez nemogočih procesov in pridobitev gospodarskih koristi.
Raznolikost kemijskih procesov
Glede na posebnosti toplotnega učinka se mnoge reakcije pripisujejo ekso- ali endotermičnemu. Prvi pride z nastajanjem toplote, na primer oksidacijo ogljika, hidratacijo koncentrirane žveplove kisline. Druga vrsta sprememb je povezana s absorpcijo toplotne energije. Primeri endotermnih reakcij: razpad kalcijev karbonat z izobraževanjem hidrirano apno in ogljikov dioksid nastajanje vodika in ogljika med toplotno razgradnjo metana. V enačbah eksotermnih in endotermnih procesov je potrebno navesti termični učinek. Prerazporeditev elektronov med atomi reagirajočih snovi se pojavi v redoks reakcijah. Štiri vrste kemijskih procesov se razlikujejo po značilnostih reagentov in proizvodov:
- spojina A + B = C;
- razgradnja C = A + B;
- substitucija AB + C = AC + B;
- izmenjava AB + SD = AC + VD.
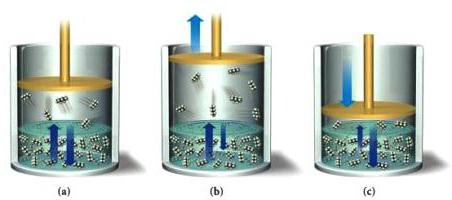
Za karakterizacijo procesov je pomembna popolnost interakcije reagentnih spojin. Ta značilnost je podlaga za delitev reakcij na reverzibilne in nepovratne.
Reverzibilnost reakcij
Reverzibilni procesi tvorijo večino kemijskih pojavov. Nastajanje končnih produktov iz reagentov je neposredna reakcija. V obratni smeri izvirne snovi dobimo iz produktov njihove razgradnje ali sinteze. V reakcijski zmesi pride do kemičnega ravnovesja, pri katerem dobimo toliko spojin, kot se začetne molekule razgradijo. Pri reverzibilnih procesih se namesto znaka "=" med reagenti in proizvodi uporabljajo simboli "↔" ali "⇌". Puščice so lahko neenakomerne dolžine zaradi prevlade ene od reakcij. V kemijskih enačbah lahko označimo agregativne lastnosti snovi (d - plini, g - tekočine, t - trdne snovi). Zelo praktičen pomen imajo znanstveno utemeljene metode vpliva na reverzibilne procese. Tako je proizvodnja amoniaka postala dobičkonosna po ustvarjanju pogojev, ki premikajo ravnotežje proti tvorbi ciljnega produkta: 3H2 (g) + N2 (g) 2NH3 (g) . Nepovratni pojavi vodijo v nastanek netopne ali slabo topne spojine, nastajanje plina, ki zapušča reakcijsko kroglo. Ti postopki vključujejo ionsko izmenjavo, razgradnjo snovi.
Kemijsko ravnovesje in pogoji za njegovo premikanje
Na značilnosti neposrednih in povratnih procesov vpliva več dejavnikov. Eden od njih je čas. Koncentracija snovi, ki jo jemljemo za reakcijo, se postopoma zmanjšuje in koncentracija končne spojine narašča. Reakcija v smeri naprej je počasnejša, obratni proces je hitrejši. V določenem intervalu potekajo sinhrono dva nasprotna procesa. Pojavi se interakcija med snovmi, vendar se koncentracije ne spremenijo. Razlog je dinamično kemično ravnovesje, ki je vzpostavljeno v sistemu. Njena ohranitev ali sprememba je odvisna od:
- temperaturne razmere;
- koncentracije spojin;
- tlak (za pline).
Premik kemičnega ravnovesja
Leta 1884 je izjemen francoski znanstvenik, A. L. Le Chatelier, predlagal opis, kako sistem iziti iz stanja dinamičnega ravnovesja. Metoda temelji na načelu izravnavanja delovanja zunanjih dejavnikov. Le Chatelier je opazil, da v reakcijski zmesi obstajajo procesi, ki kompenzirajo vpliv zunanjih sil. Načelo, ki ga je oblikoval francoski raziskovalec, navaja, da sprememba razmer v stanju ravnovesja daje prednost reakciji, ki slabi zunanji učinek. Ravnotežni premik se drži tega pravila, opazimo ga, ko se sestava, temperaturni pogoji in tlak spremenijo. Tehnologije, ki temeljijo na ugotovitvah znanstvenikov, se uporabljajo v industriji. Mnogi kemijski procesi, ki so veljali za praktično neizvedljive, se izvajajo zahvaljujoč metodam premikanja ravnotežja.

Učinek koncentracije
Premik v ravnotežju se pojavi, ko so določene komponente odstranjene iz interakcijske cone ali pa so uvedeni dodatni deli snovi. Odstranjevanje produktov iz reakcijske zmesi običajno povzroči povečanje hitrosti njihovega nastajanja, nasprotno pa dodajanje snovi vodi do njihove prednostne razgradnje. V postopku esterifikacije za dehidracijo uporabite žveplove kisline. Pri vnosu v reakcijsko kroglo se poveča izkoristek metil acetata: CH 3 COOH + CH 3 OH O CH 3 COOCH 3 + H 2 O. Če dodate kisik, ki sodeluje z žveplov dioksid, To kemijsko ravnovesje se premakne k neposredni reakciji nastajanja žveplovega trioksida. Kisik se veže na molekule SO 3 , njegova koncentracija se zmanjšuje, kar je skladno z Le Chatelierovim pravilom za reverzibilne procese.
Sprememba temperature
Procesi z absorpcijo ali toplotno energijo so endo- in eksotermni. Za premik ravnotežja se uporablja toplota ali toplota iz reakcijske zmesi. Povišanje temperature spremlja povečanje stopnje endotermnih pojavov, v katerih se absorbira dodatna energija. Hlajenje vodi v prednost eksotermnih procesov, s sproščanjem toplote. Ko ogljikov dioksid sodeluje s premogom, se segrevanje spremlja s povečanjem koncentracije monoksida, hlajenje pa vodi do prevladujoče tvorbe saj: CO 2 (g) + C (t) 2CO (g) .
Učinek pritiska
Sprememba tlaka je pomemben dejavnik za reagiranje zmesi, ki vključujejo plinaste spojine. Prav tako bodite pozorni na razliko v količinah prvotnih in nastalih snovi. Zmanjšanje tlaka vodi do prevladujočega poteka pojavov, v katerih se poveča skupna prostornina vseh komponent. Povečanje pritiska usmerja proces k zmanjševanju obsega celotnega sistema. Ta vzorec opazimo v reakciji tvorbe amoniaka: 0,5 N 2 (g) + 1,5 H 2 (g) NH 3 (g) . Sprememba tlaka ne bo vplivala na kemijsko ravnovesje v tistih reakcijah, ki se pojavijo pri konstantnem volumnu.

Optimalni pogoji za izvajanje kemijskega procesa
Ustvarjanje pogojev za spreminjanje ravnotežja v veliki meri določa razvoj sodobnih kemijskih tehnologij. Praktična uporaba znanstvene teorije prispeva k doseganju optimalnih proizvodnih rezultatov. Najbolj izrazit primer je proizvodnja amoniaka: 0,5 N 2 (g) + 1,5 H 2 (g) NH 3 (g) . Povečanje vsebnosti molekul N 2 in H 2 v sistemu je ugodno za sintezo kompleksne snovi iz preprostih. Reakcijo spremlja sproščanje toplote, zato bo znižanje temperature povzročilo povečanje koncentracije NH3. Prostornina izhodnih komponent je večja od ciljnega produkta. Povečanje tlaka bo povečalo izkoristek NH3.
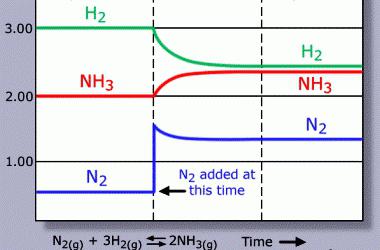
V proizvodnih pogojih se izbere optimalno razmerje med vsemi parametri (temperatura, koncentracija, tlak). Poleg tega je pomembno mesto stika med reagenti. V trdnih heterogenih sistemih povečanje površine vodi do povečanja hitrosti reakcije. Katalizatorji povečujejo hitrost neposrednih in povratnih reakcij. Uporaba snovi s takšnimi lastnostmi ne izniči kemičnega ravnovesja, temveč pospeši njegov nastanek.

