Benzojska kislina: zgodovina odkritja, lastnosti, pripravek, uporaba reagenta
Obravnava se najobsežnejši razred kemičnih spojin organske snovi. Njihova raznolikost je povezana z edinstveno sposobnostjo ogljika, da ustvari atomske verige z visoko stabilnostjo. Eden od predstavnikov organskih spojin, ki imajo benzenski obroč, je benzojska kislina. V tem članku bo opisana zanimiva zgodovina odkrivanja, široka paleta aplikacij, načinov proizvodnje, koristi in škodljivosti snovi za ljudi.
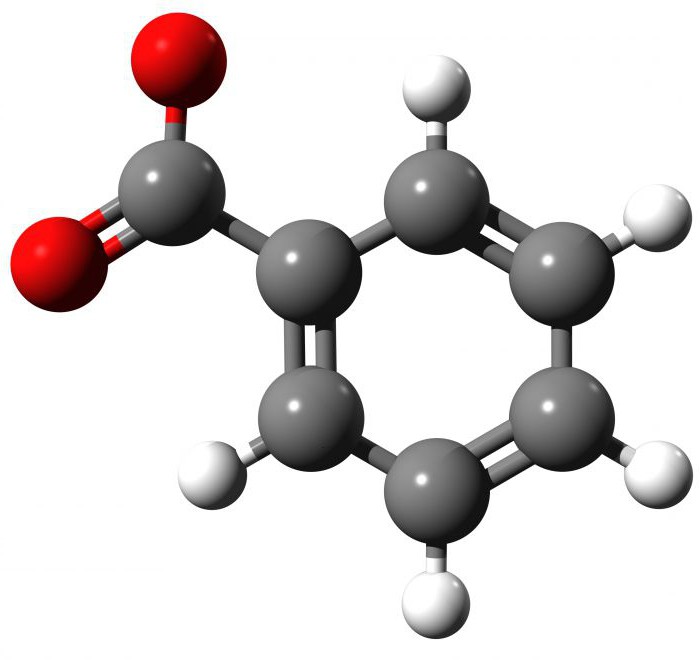
Opis, fizikalne lastnosti spojine
Pri sobni temperaturi benzojska kislina izgleda kot bel prah. Če ga pregledate pod mikroskopom, boste videli, da so kristali v obliki igel ali lusk (tablet). Spojina ima močan vonj. Kemijska formula te karboksilne (organske) kisline je C6H5COOH ali C7H6O2. Ko se segreje na 122,4 ° C, se začne taliti, pri 249 ° C - do vrenja, nadaljnje povečanje temperature na 370 ° C pa povzroči toplotno razgradnjo. Enostavno izračunamo molsko maso spojine, je 122,12 g / mol. Reagent je zelo slabo topen v vodi, v etanolu in etrih - dobro. Reagent C6H5COOH je šibka kislina, njena disociacijska konstanta je 4.202.

Sublimacija
Reagent se lahko sublimira. V tem primeru kristali sublimirajo iz hlapov, mimo tekoče faze. Takšen prehod je lahko slediti skozi izkušnjo "zime v kozarcu" ali "umetnega snega". V ta namen se v kemično odporne kemične jedi dajo majhne količine reagenta in smrekove vejice. Na vrhu je postavljena bučka z okroglim dnom z vodo, ki bo služila kot hladilnik in pokrov. Zasnova je postavljena na stojalo in podvržena ogrevanju. V tem primeru začne reagent sublimirati. Pari, ki dosežejo steklenice s hladno vodo, kristalizirajo in se spremenijo v "sneg". Ti se usedejo na vejo smreke in stene stekla v obliki tankih iglic. Super pogled! Ima praktično uporabo - sublimacija se uporablja za pridobivanje benzojske kisline.
Zgodovina odkrivanja
Benzojska kislina je dobila ime zaradi naravne spojine, iz katere je bila najprej izolirana, rosnega kadila. Ta proces je opisal Nostradamus leta 1556, malo kasneje pa francoski alkimist Blaise de Vigener. Benzoinska smola se že dolgo šteje za edini vir sinteze karboksilne kisline, za katero so jo imenovali snežna. Velik prispevek k študiji strukture in sestave spojine so opravili J. Liebig in A. Kolbe. Leta 1875 so proučevali antiseptične in antimikotične lastnosti benzojske kisline. Odkritje pripada nemškemu fiziologu E. L. Zalkowskemu. To je omogočilo uporabo reagenta v medicini.
Tipične kemijske reakcije
Benzojska kislina, katere kemijske lastnosti so neposredno odvisne od prisotnosti aromatskega obroča, vstopi v reakcijo elektrofilne substitucije. Poleg tega so bolj dovzetni za tretji ogljikov atom, ki se nahaja na enaki razdalji od karboksilne skupine. Zamenjava v —COOH poteka veliko počasneje. Za C6H5COOH so značilne enake interakcije, kot pri karboksilnih kislinah. Med reakcijo esterifikacije (z alkoholi) imajo estri prijetno aromo. Kot vse organske spojine benzojska kislina gori z sproščanjem CO 2 in vode. Interakcije z bazami in kovinami potekajo skozi karboksilno skupino z nastajanjem soli - benzoatov. Dehidracija povzroči cikloalkane. Značilna kemikalija reakcija (kakovost) na C6H5COOH je sproščanje železovega (III) benzoata. Zaradi interakcije benzojske kisline s FeCl 3 se zdi, da je rumenkasto roza oborina.
Sprejem in čiščenje
Kot smo že opisali, smo prvič izolirali benzojsko kislino iz rosnega kadila. Ta naravna spojina je stiraksna smola. Za to se zdrobljena surovina segreva v peščeni kopeli in sublimirani kristali se zberejo v majhno škatlo, pokrito s papirjem. Nastali proizvod je imel prijetno aromo zaradi prisotnosti eteričnih olj v rosnem kadilu - cimeta in vanilije.

Uporabili smo tudi metodo interakcije hipurne kisline s klorovodikovo kislino z močnim segrevanjem. Prva je bila pridobljena z izhlapevanjem urina rastlinojedcev, nato pa očiščena s kristalizacijo, dokler značilen vonj ni izginil. Kaj pa sodobna sinteza take snovi kot benzojska kislina? Da je zelo poceni, preprosta in okolju prijazna. Izvaja se z industrijsko oksidacijo metilbenzena KMnO 4 ali z delnim medsebojnim delovanjem začetnega reagenta z O2. Čiščenje surovin temelji na fizikalnih lastnostih reagenta - nizka topnost benzojske kisline v mrzli vodi in v vroči vodi ter se imenuje rekristalizacija.
Nepogrešljiv konzervans
Ko pregledujete oznake na živilih, pogosto naletite na E-kodirane komponente. Pod to oznako so različna barvila, arome, emulgatorji, konzervansi in ojačevalci okusa. Benzojsko kislino najdete pod oznako E210. Ta prehranski dodatek je naravni konzervans, ki se proizvaja v mlečnih proizvodih na naraven način. V naravi je spojino mogoče najti v različnih delih rastlin, smol, bober potoku. E210 se uporablja pri proizvodnji živilskih izdelkov - omake, juhe, želeji, konzervirana živila, pijače. Ker je komponenta malo topna v vodi, pogosteje jemljemo soli benzojske kisline, na primer: natrijevega benzoata z oznako E211.

Učinek spojine na človeško telo
Konzervans E210, Vdihni v človeško telo, reagira z beljakovinami, ki tvorijo hipurinsko kislino, ki se izloča skozi ledvice. To komponento odobri Združenje WHO, vendar le v koncentraciji, ki ne presega 5 mg / kg dnevnega vnosa. V velikih odmerkih lahko benzojska kislina poškoduje jetra in ledvice. Poleg tega morate paziti na izdelke, v katerih je konzervans prisoten skupaj z vitaminom C. Interakcija teh sestavin vodi do nastajanja prostega benzena, ki je najmočnejši rakotvornik.
Uporaba
Benzojska kislina se ni uporabljala samo v živilski industriji. Uporablja se v medicini kot dezinfekcijsko in protiglivično sredstvo, dodano ekspektorantnim zdravilom in mazilom za kožne bolezni. Reagent je surovina za kemično sintezo fenola, mehčalcev in barvil. Za parfumerijo so zelo pomembni estri benzojske kisline. Uporabljajo se kot fiksirne naprave za arome. Da ne bi prišlo do zastrupitve, uporabite zaščito kože in pljuč, saj vnos reagenta v telo povzroči opekline, draženje sluznice, slabost.