Zakon ohranjanja mase v kemiji. Odkritje zakona
Zakon o ohranjanju mase je osnova za izračun fizičnih procesov na vseh področjih človekovega delovanja. Njegovo pravičnost ne izpodbijajo fiziki, kemiki ali predstavniki drugih znanosti. Ta zakon kot strog računovodja spremlja skladnost z natančno maso snovi pred in po interakciji z drugimi snovmi. Čast odkritja tega zakona pripada ruskemu znanstveniku M. V. Lomonosovu.
Začetno razumevanje sestave snovi
Struktura snovi je stoletja ostala skrivnost za vsako osebo. Različne hipoteze so vznemirile znanstvenike in motivirale modrece k dolgim in nesmiselnim sporom. Eden je trdil, da je vse sestavljeno iz požara, druga pa je zagovarjala popolnoma drugačno stališče. V množici teorij, ki so bleskale, in teorija starogrškega modreca Demokrita, da so vse snovi sestavljene iz drobnih, drobnih delcev snovi, ki so nevidni očesu, je bilo nepravično pozabljeno. Demokrit jih je imenoval "atomi", kar pomeni "nedeljivo". Na žalost je bila njegova predpostavka že več kot 23 stoletij pozabljena.
Alkemija
Večina znanstvenih podatkov srednjega veka je temeljila na predsodkih in različnih špekulacijah. Alkemija se pojavlja in je razširjena, kar je bila zbirka skromnih praktičnih znanj, ki so bila zelo zaokrožena z najbolj fantastičnimi teorijami. Znani tisti časi so na primer skušali svinec pretvoriti v zlato in najti neznani filozofski kamen, ki zdravi vse bolezni. V procesu iskanja postepeno nabranih znanstvenih izkušenj, ki jih sestavljajo številne nepojasnjene reakcije kemijskih elementov. Ugotovljeno je bilo na primer, da mnoge snovi, ki se pozneje imenujejo preproste, ne razpadejo. Tako je oživela starodavna teorija nedeljivih delcev snovi. Odlično je bilo, če bi to shranjevanje informacij spremenili v koherentno in logično teorijo. 
Lomonosova teorija
Natančna kvantitativna metoda raziskovalne kemije je obvezna za ruskega znanstvenika M. V. Lomonosova. Za svoje briljantne sposobnosti in trdo delo je prejel naziv profesorja kemije in postal član Ruske akademije znanosti. Pod njim je bil organiziran prvi sodobni kemijski laboratorij v državi, v katerem je bil odkrit slavni zakon ohranjanja mase snovi. 
V procesu proučevanja toka kemijske reakcije Lomonosov je pretehtal prvotne kemikalije in izdelke, ki so se pojavili po reakciji. Hkrati je odkril in oblikoval zakon ohranjanja mase snovi. V 17. stoletju se je pojem mase pogosto zamenjal z izrazom »teža«. Zato se množice snovi pogosto imenujejo "uteži". Lomonosov je ugotovil, da je struktura snovi neposredno odvisna od delcev, iz katerih je zgrajena. Če vsebuje delce iste vrste, je znanstvenik takšno snov imenoval preprosto. S heterogeno sestavo krvnih celic dobimo kompleksno snov. Ti teoretični podatki so omogočili, da je Lomonosov oblikoval zakon o ohranjanju mase.
Opredelitev prava
Po številnih poskusih je MV Lomonosov ustanovil zakon, katerega bistvo je bilo naslednje: masa snovi, ki so vstopile v reakcijo, je enaka masi snovi, ki so bile pridobljene kot rezultat reakcije. 
V ruski znanosti se ta postulat imenuje »Zakon o ohranjanju mase Lomonosovih snovi«.
Ta zakon je bil oblikovan leta 1748 in leta 1756 so bili izvedeni najbolj natančni poskusi z reakcijo kurjenja kovin v zapečatenih posodah.
Lavoisierjevi poskusi
Evropska znanost je odkrila zakon ohranjanja mase po objavi opisa del velikega francoskega kemika Antoina Lavoisierja.  Ta znanstvenik je pogumno uporabil teoretične ideje in fizikalne metode časa v svojih poskusih, kar mu je omogočilo, da je razvil kemijsko nomenklaturo in ustvaril register vseh kemikalij, ki so bile takrat znane.
Ta znanstvenik je pogumno uporabil teoretične ideje in fizikalne metode časa v svojih poskusih, kar mu je omogočilo, da je razvil kemijsko nomenklaturo in ustvaril register vseh kemikalij, ki so bile takrat znane.
S svojimi eksperimenti je Lavoisier dokazal, da se med kemično reakcijo opazuje zakon o ohranjanju mase snovi, ki vstopajo v spojino. Poleg tega je razširil zakon o ohranjanju na maso vsakega od elementov, ki so sodelovali v reakciji kot del kompleksnih snovi.
Na vprašanje, kdo je odkril zakon ohranjanja mase snovi, je torej mogoče odgovoriti na dva načina. MV Lomonosov je bil prvi, ki je izvedel poskuse, ki živo prikazujejo zakon ohranjanja, in ga pripeljal pod teoretično osnovo. A. Lavoisier, leta 1789, neodvisno od ruskega znanstvenika, neodvisno odkrije zakon ohranjanja mase in razširja svoje načelo na vse elemente, ki sodelujejo pri kemični reakciji.
Masa in energija
Leta 1905 je veliki A. Einstein pokazal povezavo med maso snovi in njeno energijo. Izražena je bila s formulo:
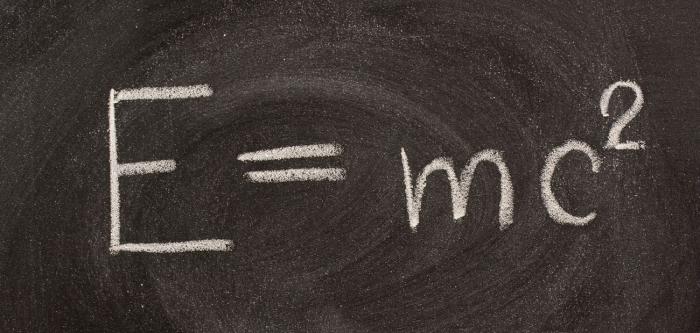
Einsteinova enačba potrjuje zakon ohranjanja mase in energije. Ta teorija navaja, da ima vsaka energija maso, sprememba te energije pa je sprememba telesne mase. Potencialna energija vsako telo je zelo veliko in se lahko osvobodi samo pod posebnimi pogoji.
Zakon ohranjanja mase velja za vse organe mikro in makrokozmosa. Vsaka kemijska reakcija je vključena v pretvorbo notranje energije snovi. Zato bi bilo treba pri izračunu mase snovi, vključenih v kemične reakcije, upoštevati povečanje ali zmanjšanje mase, ki jo povzroči sproščanje ali absorpcija energije v danem odzivu. Dejansko je v makrokozmosu ta učinek tako nepomemben, da je mogoče takšne spremembe prezreti.