Funkcija in struktura proteina
Beljakovine so organske visoko molekularne spojine. Te snovi se imenujejo tudi proteini, polipeptidi. Nato razmislite o strukturi in funkciji beljakovin.
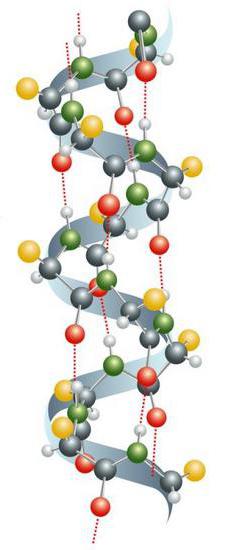
Splošne informacije
Kemijsko strukturo beljakovin predstavljajo alfa-aminokisline, povezane v verigo preko peptidne vezi. V živih organizmih sestava določa genetsko kodo. V postopku sinteze se v večini primerov uporablja 20 aminokislin standardnega tipa. Mnoge njihove kombinacije tvorijo proteinske molekule s široko paleto lastnosti. Aminokislinski ostanki so pogosto izpostavljeni post-translacijskim modifikacijam. Lahko se pojavijo, preden beljakovina začne izvajati svoje funkcije, in v procesu svoje dejavnosti v celici. V živih organizmih pogosto več molekul tvori kompleksne komplekse. Primer za to je fotosintetično združenje.
Dodelitev povezave
Beljakovine veljajo za pomembno sestavino prehrane ljudi in živali zaradi dejstva, da v njihovih organizmih ni mogoče sintetizirati vseh potrebnih aminokislin. Nekateri morajo priti skupaj beljakovinske hrane. Glavni viri spojin so meso, oreški, mleko, ribe, žita. V manjši meri so beljakovine prisotne v zelenjavi, gobah in jagodah. Med prebavo encimov se porabljeni proteini uničijo do aminokislin. Uporabljajo se že v biosintezi lastnih beljakovin v telesu ali so podvržene nadaljnjemu propadanju - za energijo.
Zgodovinsko ozadje
Zaporedje strukture insulinskega proteina je prvič določil Frederius Senger. Za svoje delo je leta 1958 prejel Nobelovo nagrado. Sanger je uporabil metodo sekvenciranja. Uporaba difrakcije rentgensko sevanje kasneje smo dobili tridimenzionalne strukture mioglobina in hemoglobina (konec petdesetih let). Delo sta izvedla John Kendrew in Max Perutz.
Struktura proteinskih molekul
Vključuje linearne polimere. Ti pa so sestavljeni iz alfa-aminokislinskih ostankov, ki so monomeri. Poleg tega lahko proteinska struktura vključuje komponente, ki imajo naravo ne-amino kisline, in aminokislinske ostanke modificiranega tipa. Pri označevanju sestavnih delov se uporabljajo 1-ali 3-črkovne okrajšave. Spojina, ki vsebuje od dva do več ducatov ostankov, se pogosto imenuje "polipeptid". Kot posledica interakcije alfa-karboksilne skupine ene aminokisline z alfa-amino skupino druge, se pojavijo vezi (v času nastajanja proteinske strukture). V spojini izoliramo C- in N-konce, odvisno od tega, katera skupina aminokislinskega ostanka je prosta: -COOH ali -NH2. V teku sintezo beljakovin na ribosomu kot prvi terminal praviloma deluje metioninski ostanek; pristop naslednjega poteka na C-konec prejšnjih
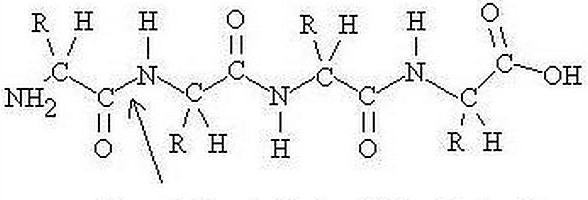
Ravni organizacije
Ponudila jih je Lindrem-Lang. Čeprav se ta delitev šteje za nekoliko zastarelo, se še vedno uporablja. Predlagano je bilo razlikovanje štirih stopenj organizacije povezav. Primarno strukturo proteinske molekule določajo genetski kod in značilnosti gena. Za višje nivoje je značilna tvorba med zlaganjem beljakovin. Prostorska struktura proteina je določena v celotni verigi aminokislin. Kljub temu je precej labilen. Na to lahko vplivajo zunanji dejavniki. V zvezi s tem je pravilneje govoriti o konformaciji spojine, najbolj koristni in prednostni energiji.
Raven 1
Predstavljen je z zaporedjem aminokislinskih ostankov polipeptidne verige. Praviloma je opisan z enim ali tremi črkami. Primarno strukturo proteinov označujejo stabilne kombinacije aminokislinskih ostankov. Opravljajo določene naloge. Takšni "konzervativni motivi" ostajajo ohranjeni med evolucijo vrst. Po njihovem mnenju lahko pogosto napovedujete problem neznanega proteina. Z vrednotenjem stopnje podobnosti (homologije) v verigi aminokislin različnih organizmov je mogoče določiti evolucijsko razdaljo med taksoni, ki tvorijo te organizme. Primarno strukturo beljakovin določimo z metodo sekvenciranja ali z začetnim kompleksom mRNA z uporabo tabele genetske kode.
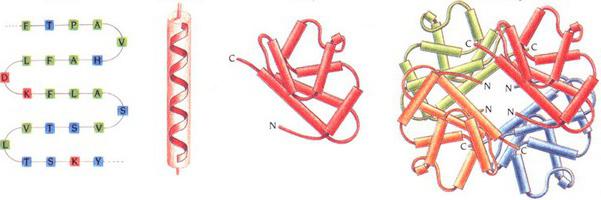
Lokalno urejanje verižnega odseka
To je naslednja raven organizacije - sekundarna struktura beljakovin. Obstaja več vrst. Lokalno urejanje verigi polipeptida stabiliziramo z vodikovimi vezmi. Najbolj priljubljene vrste so:
- Alfa vijačnica Predstavljene so v obliki gostih kolobarjev okoli dolge molekularne osi. En zavoj je sestavljen iz 3,6 aminokislinskih ostankov. Višina vijaka je 0,54 nm. Ta sekundarna proteinska struktura je stabilizirana z interakcijami H- in O-peptidnih skupin, ki so 4 enote za seboj. Alfa heliks je lahko levičar ali desničar. Slednji se najpogosteje zazna v beljakovinskih spojinah. Elektrostatične interakcije arginina, lizina, glutaminska kislina. V neposredni bližini lahko ostanki levcina, treonina, serina in asparagina povzročijo sterične motnje tvorbe. Kršitev alfa-vijačnice (njenega upogiba) povzročijo deli prolina.
- Beta seznami. Predstavljene so v obliki več cik cak polipeptidnih verig. V njih se tvorijo vodikove vezi med aminokislinami, relativno oddaljenimi v primarni strukturi, ali različnimi beljakovinskimi verigami. Povezave so običajno usmerjene N-konci v nasprotni smeri (anti-vzporedna usmeritev). Pri oblikovanju seznamov beta je pomembna majhna velikost stranskih skupin aminokislin.
- Neurejeni fragmenti.
- 310- in π-vijačnica in drugo.

Prostorska struktura
Terciarna struktura proteinov vključuje elemente prejšnje ravni. Stabilizirajo jih različne vrste interakcij. Hidrofobne vezi so izjemnega pomena. Pri stabilizaciji so vključeni:
- Kovalentne interakcije.
- Ionske vezi, ki nastanejo med stranskimi skupinami aminokislin, ki imajo nasprotne naboje.
- Interakcije z vodikom.
- Hidrofobne vezi. V procesu interakcije z okoliškimi H 2 O elementi pride do prekrivanja beljakovin tako, da se stranske nepolarne aminokislinske skupine izolirajo iz vodne raztopine. Na površini molekule se pojavijo hidrofilne skupine (polarne).
Terciarno strukturo proteinov določajo magnetne (jedrske) resonančne metode, nekatere vrste mikroskopije in druge metode.
Načelo polaganja
Študije so pokazale, da je med 2 in 3 stopnjami primerno dodeliti drugo. Imenuje se "arhitektura", "styling motiv". Določena je z relativnim položajem komponent sekundarne strukture (beta trakovi in alfa heliki) znotraj meja kompaktne globule, beljakovinske domene. Lahko obstaja neodvisno ali pa je vključen v sestavo večje beljakovine skupaj z drugimi podobnimi. Ugotovljeno je, da so motivi oblikovanja precej konzervativni. Najdemo jih v beljakovinah, ki nimajo niti evolucijske niti funkcionalne vezi. Opredelitev arhitekture temelji na racionalni (fizični) klasifikaciji.
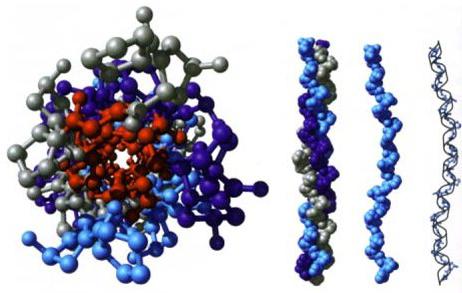
Domena
Z medsebojno razporeditvijo več polipeptidnih verig znotraj enega proteinskega kompleksa nastane kvarterna proteinska struktura. Elementi, vključeni v njegovo sestavo, se na ribosomih oblikujejo ločeno. Šele na koncu sinteze se ta beljakovinska struktura začne oblikovati. Vsebuje lahko različne in identične polipeptidne verige. Kvartarna struktura proteinov se stabilizira zaradi enakih interakcij kot na prejšnji ravni. Nekateri kompleksi lahko vključujejo več ducatov beljakovin.
Struktura beljakovin: obrambni cilji
Polipeptidi citoskeleta, ki delujejo na nek način kot armatura, oblikujejo številne organoide in sodelujejo pri njegovi spremembi. Strukturni proteini zagotavljajo zaščito telesa. Na primer, ta beljakovina je kolagen. Je osnova medcelične snovi vezivnega tkiva. Keratin ima tudi zaščitno funkcijo. Je osnova rogov, perja, las in drugih derivatov povrhnjice. Ko se beljakovina v mnogih primerih veže na toksine, pride do razstrupljanja slednjih. To je naloga kemijske obrambe telesa. Posebno pomembno vlogo v procesu nevtralizacije toksinov v človeškem telesu igrajo jetrni encimi. Sposobni so razdeliti strupe ali jih prevesti v topno obliko. To prispeva k hitrejšemu transportu iz telesa. Beljakovine, prisotne v krvi in drugih bioloških tekočinah, zagotavljajo imunsko zaščito, kar povzroča reakcijo tako na napad patogenov kot tudi na poškodbe. Imunoglobulini (protitelesa in komponente sistema komplementa) lahko nevtralizirajo bakterije, tuje beljakovine in viruse.
Regulacijski mehanizem
Proteinske molekule, ki ne delujejo kot vir energije ali kot gradbeni material, nadzorujejo številne znotrajcelične procese. Zato se zaradi njih izvaja regulacija prevajanja, transkripcija, rezanje, aktivnost drugih polipeptidov. Mehanizem regulacije temelji na encimski aktivnosti ali se manifestira zaradi specifične vezave na druge molekule. Na primer, transkripcijski faktorji, aktivatorski polipeptidi in represorski proteini so sposobni nadzorovati intenzivnost transkripcije gena. Hkrati medsebojno delujejo z regulatornimi zaporedji genov. Najpomembnejšo vlogo pri nadzoru poteka intracelularnih procesov imajo beljakovinske fosfataze in proteinske kinaze. Ti encimi sprožijo ali zavirajo aktivnost drugih proteinov z dodajanjem ali cepitvijo fosfatnih skupin iz njih.
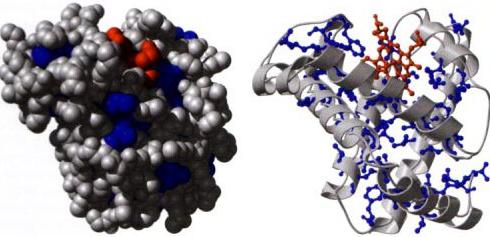
Naloga signalizacije
Pogosto je povezana z regulativno funkcijo. To je posledica dejstva, da lahko številni intracelularni, pa tudi zunajcelični polipeptidi prenašajo signale. Rastni faktorji, citokini, hormoni in druge spojine imajo to sposobnost. Steroidi se prenašajo s krvjo. Interakcija hormona s receptorjem deluje kot signal, zaradi česar se sproži odziv celice. Steroidi nadzorujejo vsebnost spojin v krvi in celicah, razmnoževanje, rast in druge procese. Primer je insulin. Regulira raven glukoze. Interakcija celic poteka s pomočjo signalnih proteinskih spojin, ki se prenašajo preko medcelične snovi.
Prevoz elementov
Topni proteini, ki sodelujejo pri premikanju majhnih molekul, imajo visoko afiniteto za substrat, ki je prisoten v povišanih koncentracijah. Prav tako imajo možnost, da jo zlahka sprostijo na območjih z nizko vsebnostjo. Primer je transportni protein hemoglobin. Premakne kisik iz pljuč v druga tkiva in iz njih - prenaša ogljikov dioksid. Nekateri membranski proteini sodelujejo tudi pri prenosu majhnih molekul skozi celične stene in jih spreminjajo. Citoplazmatska lipidna plast je vodoodporna. To preprečuje difuzijo nabitih ali polarnih molekul. Membranske transportne povezave lahko razdelimo na nosilce in kanale.
Redundantne povezave
Te beljakovine tvorijo ti rezerve. Nabirajo se, na primer, v semenih rastlin, živalskih jajc. Takšne beljakovine delujejo kot rezervni vir snovi in energije. Nekatere spojine telo uporablja kot aminokislinski rezervoar. Po drugi strani so predhodniki aktivnih snovi, ki sodelujejo pri uravnavanju presnove.
Celične receptorje
Takšne beljakovine se lahko nahajajo bodisi neposredno v citoplazmi bodisi v steni. En del povezave prejme signal. Praviloma je to običajno kemična snov, v nekaterih primerih pa mehansko (raztezanje), svetloba in drugi dražljaji. V procesu izpostavljanja signala določenemu fragmentu molekule - polipeptidnemu receptorju - se začnejo njene konformacijske spremembe. Izzovejo spremembo konformacije preostalega dela, ki dražljaje prenese na druge komponente celice. Pošiljanje signala se lahko izvede na različne načine. Nekateri receptorji so sposobni katalizirati kemijsko reakcijo, medtem ko slednji delujejo kot ionski kanali, ki se zapirajo ali odpirajo pod vplivom dražljaja. Nekatere spojine specifično vežejo posredne molekule v celici.
Motorni polipeptidi
Obstaja cel razred beljakovin, ki zagotavljajo gibanje telesa. Motorne beljakovine so vključene v mišično kontrakcijo, gibanje celic, aktivnost zastavic in cilij. Zaradi njih se izvaja tudi usmerjen in aktivni transport. Kinezini in dineini prenašajo molekule vzdolž mikrotubulov z uporabo ATP kot energetskega vira hidrolize. Slednje premikajo organoide in druge elemente proti centrosomu iz perifernih celičnih mest. Kinezi se gibljejo v nasprotni smeri. Dyneiny, poleg tega, so odgovorni za aktivnost zastavic in cilij.