Kemični element je ... Periodni sistem kemijskih elementov
Kemični element je skupni izraz, ki opisuje niz atomov preproste snovi, to je tisti, ki je ni mogoče razdeliti na nobene preprostejše (v strukturi njihovih molekul) komponente. Predstavljajte si, da dobite kos čistega železa z zahtevo, da ga razdelite v hipotetične komponente z uporabo katerekoli naprave ali metode, ki so jo kdajkoli izumili kemiki. Vendar pa ne morete storiti ničesar, nikoli železa se ne razdeli na nekaj enostavnejšega. Preprosta snov - železo - ustreza kemičnemu elementu Fe. 
Teoretična opredelitev
Zgoraj omenjeno eksperimentalno dejstvo je mogoče razložiti s pomočjo te definicije: kemijski element je abstrakten niz atomov (ne molekul!) Ustrezne preproste snovi, to je atomov iste vrste. Če obstaja način, da pogledamo vsakega od posameznih atomov v kosu čistega železa, omenjenega zgoraj, potem bi bili vsi isti - železovi atomi. V nasprotju s tem kemična spojina, kot je železov oksid, vedno vsebuje vsaj dva različna tipa atomov: atome železa in atome kisika.
Pogoji, ki jih morate poznati
Atomska masa : masa protonov, nevtronov in elektronov, ki tvorijo atom kemičnega elementa.
Atomsko število : število protonov v jedru atoma elementa.
Kemijski simbol : črka ali par latinskih črk, ki predstavljajo oznako tega elementa.
Kemična spojina : Snov, ki je sestavljena iz dveh ali več kemičnih elementov, ki so med seboj povezani v določenem razmerju.
Metal : element, ki izgubi elektrone v kemijske reakcije z drugimi elementi.
Metalloid : element, ki včasih reagira kot kovina, včasih tudi kot nekovina.
Nekovinski : element, ki skuša ustvariti elektrone v kemijskih reakcijah z drugimi elementi.
Periodični sistem kemijskih elementov : sistem razvrščanja kemijskih elementov v skladu z njihovimi atomskimi številkami.
Sintetični element : tisti, ki je umetno pridobljen v laboratoriju in praviloma ni v naravi. 
Naravni in sintetični elementi
V naravi najdemo 92 kemijskih elementov na Zemlji. Preostali delci so bili pridobljeni umetno v laboratorijih. Sintetični kemični element je običajno produkt jedrskih reakcij v pospeševalnikih delcev (naprave, ki se uporabljajo za povečanje hitrosti subatomskih delcev, kot so elektroni in protoni) ali jedrskih reaktorjev (naprave, ki se uporabljajo za nadzor energije, sproščene med jedrskimi reakcijami). Prvi sintetični element z atomsko številko 43 je bil tehnecij, ki so ga leta 1937 odkrili italijanski fiziki C. Perrier in E. Segre. Poleg tehnecija in prometija imajo vsi sintetični elementi tudi jedra, ki so večje od uranovih. Slednje, ki je dobilo ime, je sintetični kemični element - jetermorium (116) in pred njim flamerij (114). 
Dva ducata skupnih in pomembnih elementov
| Ime | Simbol | Odstotek vseh atomov * | Lastnosti kemijskih elementov (pri normalnih sobnih pogojih) | |||
| V vesolju | V zemeljski skorji | V morski vodi | V človeškem telesu | |||
| Aluminij | Al | - | 6.3 | - | - | Lahka srebrna kovina |
| Kalcij | Ca | - | 2.1 | - | 0,02 | Vključeni v sestavo naravnih mineralov, lupin, kosti |
| Ogljik | S | - | - | - | 10.7 | Osnova vseh živih organizmov |
| Klor | Cl | - | - | 0,3 | - | Strupni plin |
| Baker | Cu | - | - | - | - | Samo rdeča kovina |
| Zlato | Au | - | - | - | - | Samo rumena kovina |
| Helij | On | 7.1 | - | - | - | Zelo lahek plin |
| Vodik | H | 92.8 | 2.9 | 66.2 | 60.6 | Najlažji od vseh elementov; plina |
| Jod | I | - | - | - | - | Nemetall; uporablja kot antiseptik |
| Železo | Fe | - | 2.1 | - | - | Magnetna kovina; včasih proizvodnja litega železa in postal |
| Svinec | Pb | - | - | - | - | Mehka težka kovina |
| Magnezij | Mg | - | 2.0 | - | - | Zelo lahka kovina |
| Živo srebro | Hg | - | - | - | - | Tekoča kovina; enega od dveh tekočinskih elementov |
| Nikelj | Ni | - | - | - | - | Kovinska odporna kovina; uporabljajo v kovancih |
| Dušik | N | - | - | - | 2.4 | Plin, glavna sestavina zraka |
| Kisik | Oh | - | 60.1 | 33.1 | 25.7 | Plin, drugi pomemben komponento zraka |
| Fosfor | R | - | - | - | 0,1 | Nemetall; pomembna za rastline |
| Kalij | Za | - | 1.1 | - | - | Kovina; pomembna za rastline; običajno imenujemo "pepelika" |
* Če vrednost ni določena, je postavka manjša od 0,1 odstotka.
Big Bang kot temeljni vzrok za nastanek snovi
Kaj je bil prvi kemični element v vesolju? Znanstveniki menijo, da je odgovor na to vprašanje v zvezdah in v procesih, v katerih nastajajo zvezde. Verjamemo, da je vesolje nastalo v nekem trenutku od 12 do 15 milijard let nazaj. Do tega trenutka se ne zavedamo nič drugega kot energijo. Zgodilo se je nekaj, kar je to energijo spremenilo v ogromno eksplozijo (tako imenovani Big Bang). V naslednjih sekundah, po Velikem poku, se je začela stvar oblikovati.
Prve protozojske oblike snovi so bili protoni in elektroni. Nekateri so združeni v vodikove atome. Slednji sestavlja en proton in en elektron; je najpreprostejši atom, ki lahko obstaja. 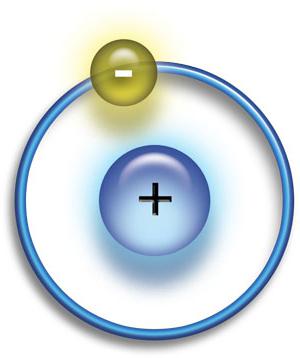 Počasi, v daljšem časovnem obdobju, so se atomi vodika začeli združevati na določenih področjih prostora, pri čemer so tvorili gosto oblak. Vodik v teh oblakih je bil kompakten. gravitacijske sile. Na koncu so ti oblaki vodika postali dovolj gosti, da tvorijo zvezde.
Počasi, v daljšem časovnem obdobju, so se atomi vodika začeli združevati na določenih področjih prostora, pri čemer so tvorili gosto oblak. Vodik v teh oblakih je bil kompakten. gravitacijske sile. Na koncu so ti oblaki vodika postali dovolj gosti, da tvorijo zvezde.
Zvezde kot kemijski reaktorji novih elementov
Zvezda je preprosto masa snovi, ki generira energijo jedrskih reakcij. Najpogostejša od teh reakcij je kombinacija štirih atomov vodika, ki tvorijo en atom helija. Takoj, ko so se začele oblikovati zvezde, je helij postal drugi element, ki se je pojavil v vesolju.
Ko se starajo, se premaknejo od jedrskih reakcij na vodikov helij na druge vrste. V njih atomi helija tvorijo ogljikove atome. Kasneje ogljikovi atomi tvorijo kisik, neon, natrij in magnezij. Še kasneje se neon in kisik med seboj združujeta, da tvorita magnezij. Ko se te reakcije nadaljujejo, nastajajo vedno več kemičnih elementov.
Prvi sistemi kemijskih elementov
Pred več kot 200 leti so kemiki začeli iskati načine, kako jih razvrstiti. Sredi devetnajstega stoletja je bilo znanih približno 50 kemičnih elementov. Eno od vprašanj, ki so jih kemiki poskušali rešiti. je bilo to: kemični element je popolnoma drugačna snov od katerega koli drugega elementa? Ali pa so nekateri elementi na nek način povezani z drugimi? Ali obstaja splošni zakon, ki jih združuje?
Kemiki so predlagali različne sisteme kemijskih elementov. Tako je npr. Angleški kemik William Praut leta 1815 predlagal, da so atomske mase vseh elementov mnogokratniki mase vodikovega atoma, če vzamemo, da je ena, to pomeni, da morajo biti cela števila. V tem času je J. Dalton že izračunal atomske mase mnogih elementov glede na maso vodika. Če pa je to približno za ogljik, dušik, kisik, potem se klor z maso 35,5 ni ujemal s to shemo.
Nemški kemik Johann Wolfgang Dobereiner (1780 - 1849) je leta 1829 pokazal, da lahko tri elemente iz tako imenovane halogenske skupine (klor, brom in jod) razvrstimo po njihovih relativne atomske mase. Atomska teža broma (79,9) je bila skoraj natančno povprečje atomskih mas klorja (35,5) in joda (127), in sicer 35,5 + 127 = 2 = 81,25 (blizu 79,9). To je bil prvi pristop k konstrukciji ene od skupin kemijskih elementov. Dobereiner je odkril še dve takšni triadi elementov, vendar ni uspel oblikovati splošnega periodičnega zakona.
Kako je periodični sistem kemičnih elementov
Večina zgodnjih klasifikacijskih shem ni bila zelo uspešna. Potem, okoli leta 1869, sta dva kemika naredila skoraj eno odkritje in skoraj istočasno. Ruski kemik Dmitri Mendelejev (1834-1907) in nemški kemik Julius Lothar Meyer (1830–1895) sta predlagala organizacijo elementov, ki imajo podobne fizikalne in kemijske lastnosti, v urejen sistem skupin, vrstic in obdobij. Hkrati sta Mendeleev in Meyer nakazala, da se lastnosti kemijskih elementov periodično ponavljajo glede na njihove atomske uteži.
Danes je Mendeleev na splošno obravnavan kot odkritelj periodičnega zakona, ker je naredil korak, ki ga Meyer ni sprejel. Ko so se vsi elementi nahajali v periodnem sistemu, so se pojavile nekatere vrzeli. Mendeleev je napovedal, da so to mesta za elemente, ki še niso odkriti.
Vendar pa je šel še dlje. Mendeleev je napovedal lastnosti teh še ne odprtih elementov. Vedel je, kje se nahajajo v periodnem sistemu, da bi lahko predvidel njihove lastnosti. Omeniti velja, da vsak predvideni kemični element Mendelejeva, prihodnji galij, skandij in germanij so odkrili manj kot deset let po objavi periodičnega zakona.
Kratka oblika periodnega sistema
Poskušali smo izračunati, koliko različic grafične podobe periodičnega sistema so predlagali različni znanstveniki. Izkazalo se je, da je več kot 500. Poleg tega je 80% skupnega števila variant tabel, ostalo pa so geometrijske figure, matematične krivulje, itd. Posledica tega so štiri vrste tabel, ki so našle praktično uporabo: kratke, pol-dolge, dolge in lestve (piramidalne). Slednje je predlagal veliki fizik N. Bohr.
Spodnja slika prikazuje kratko obliko. 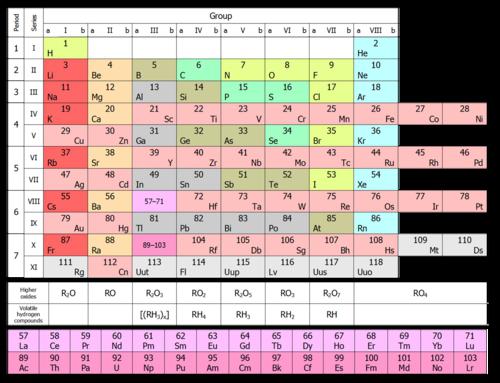 V njej so kemijski elementi razvrščeni v naraščajočem vrstnem redu njihovih atomskih števil od leve proti desni in od zgoraj navzdol. Tako ima prvi kemični element periodne tabele vodik atomsko številko 1, ker jedro vodikovih atomov vsebuje enega in samo en proton. Podobno ima kisik atomsko število 8, ker jedra vseh atomov kisika vsebujejo 8 protonov (glej spodnjo sliko).
V njej so kemijski elementi razvrščeni v naraščajočem vrstnem redu njihovih atomskih števil od leve proti desni in od zgoraj navzdol. Tako ima prvi kemični element periodne tabele vodik atomsko številko 1, ker jedro vodikovih atomov vsebuje enega in samo en proton. Podobno ima kisik atomsko število 8, ker jedra vseh atomov kisika vsebujejo 8 protonov (glej spodnjo sliko). 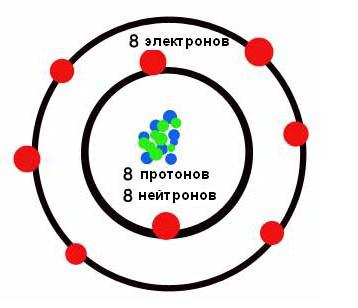
Glavni strukturni fragmenti periodičnega sistema so obdobja in skupine elementov. V šestih obdobjih so vse celice napolnjene, sedma še ni dokončana (elementi 113, 115, 117 in 118, čeprav so sintetizirani v laboratorijih, še niso uradno registrirani in nimajo imen).
Skupine so razdeljene na glavne (A) in sekundarne (B) podskupine. Elementi prvih treh obdobij, ki vsebujejo po eno vrstico, so vključeni izključno v podskupine A. Preostala štiri obdobja vključujejo dve vrsti vrstic.
Kemijski elementi v eni skupini imajo praviloma podobne kemijske lastnosti. Prva skupina je torej alkalijske kovine druga je alkalna zemlja. Elementi v istem obdobju imajo lastnosti, ki se počasi spreminjajo od alkalne kovine do plemenitega plina. Spodnja slika prikazuje, kako se ena od lastnosti - atomski polmer - spreminja za posamezne elemente v tabeli.
Dolgoročna oblika periodnega sistema
Prikazana je na spodnji sliki in je razdeljena v dve smeri, v vrsticah in stolpcih. Obstaja sedem vrstic, v kratki obliki, in 18 stolpcev, imenovanih skupine ali družine. Pravzaprav se povečanje števila skupin od 8 v kratki obliki do 18 v dolgih doseže z uvrstitvijo vseh elementov v obdobjih, ki se začnejo od četrtega, ne pa v dveh, temveč v eni vrstici.
Za skupine se uporabljata dva različna sistema številčenja, kot je prikazano na vrhu tabele. Sistem, ki temelji na rimskih številkah (IA, IIA, IIB, IVB itd.), Je tradicionalno priljubljen v Združenih državah. Drugi sistem (1, 2, 3, 4 itd.) Se tradicionalno uporablja v Evropi in je bil pred nekaj leti priporočen za uporabo v Združenih državah.

Pojav periodnih tabel na zgornjih slikah je nekoliko zavajajoč, kot v vsaki taki objavljeni tabeli. Razlog za to je, da bi morali biti dve skupini elementov, prikazani na dnu tabel, dejansko znotraj njih. Lantanidi, na primer, spadajo v obdobje 6 med barijem (56) in hafnijem (72). Poleg tega aktinidi spadajo v obdobje 7 med radijem (88) in rutherfordom (104). Če bi jih vstavili v mizo, bi postala preširoka, da bi se prilegala na list papirja ali stenske karte. Zato je običajno, da te elemente postavite na dno tabele.