Kvantno-mehanski model atoma in njegove strukture
Planetarni kvantni mehanski model Bohrovega atoma se pogosto spominja po svoji urejeni in poznani sliki elektronov. Obračajo se okoli osrednjega jedra, kot planeti okoli sonca. Zato je težko zamenjati sliko tiste, ki natančneje predstavlja kvantno-mehanski model atoma, ki ga uporabljajo sodobni fiziki.
Kako se atom premika in premika?
Atom ima drobno jedro in valove ostrih orbit. Lokacija in gibanje elektronov sta opisana z valovi njihove snovi. Te strukture napovedujejo verjetnost, da bodo v določeni regiji atoma našli elektron. Ampak od kod prihaja kvantno-mehanski model Bohrovega atoma?
Planetarni model je sprožil proces uvajanja kvantne teorije v strukturo atoma. Bohr je predstavil idejo stacionarnih stanj, v katerih je bil atom stabilen. Prehodi med temi stanjami pojasnjujejo obstoj spektralnih linij. V primeru vodika je lahko dosegel energetske nivoje:
Ad
- Prehodi med nivoji energije so ustrezali linijam v spektru vodika.
- Njegov model ni mogel predvideti energetskih nivojev za druge atome (čeprav bi se lahko ravni vodikovih alkalijskih kovin približale resnici).
Ločeno so opravili delo Heisenberga in Schrödingerja, da bi izumili načine, kako bolje opisati kvantizirane ravni energije atomov.
Analogije Heisenberga in Schrödingerja: kako sta vodila enačbo k dokazovanju vala
Kvantno-mehanski model strukture atoma ima edinstven niz lastnosti. Heisenberg je uporabil matrike in Schrödinger je razvil valovno enačbo, da dokaže absolutnost razlike v obnašanju kvanta. Dvojnost delcev je podrobneje prikazana v videu.
Ad

Schrödingerjeve enačbe zagotavljajo predstavitev gostote verjetnosti elektronov okoli jedra atoma. Večina definicij kvantne teorije in kvantne mehanike ponuja enake opise za oba. V bistvu opisujejo kvantno teorijo, v kateri imata energija in materija značilnosti valov v nekaterih razmerah in značilnosti delcev v drugih.
Da bi bila ideja jasnejša, so ljudje začeli izvajati poskuse v smislu duševne obljube.

- Kvantna teorija kaže, da energija prihaja v diskretnih paketih, ki se imenujejo kvanti (ali, v primeru elektromagnetnega sevanja, fotoni).
- Kvantna teorija ima nekaj matematičnega razvoja, ki se pogosto imenuje kvantna mehanika, ki ponuja razlage za obnašanje elektronov znotraj elektronskih oblakov atomov.
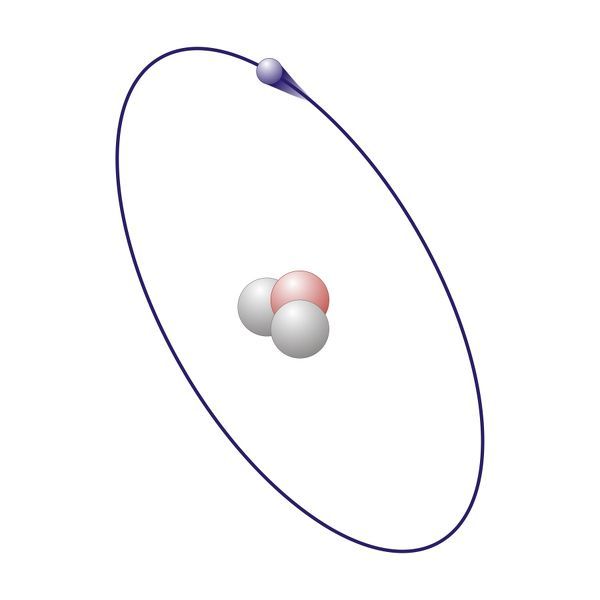
Glavne določbe kvantno-mehanskega modela strukture atoma je dvojnost elektronskih valov v oblaku elektronov, ki omejuje našo zmožnost hkratnega merjenja energije in položaja elektrona.
Skrite značilnosti elektronov
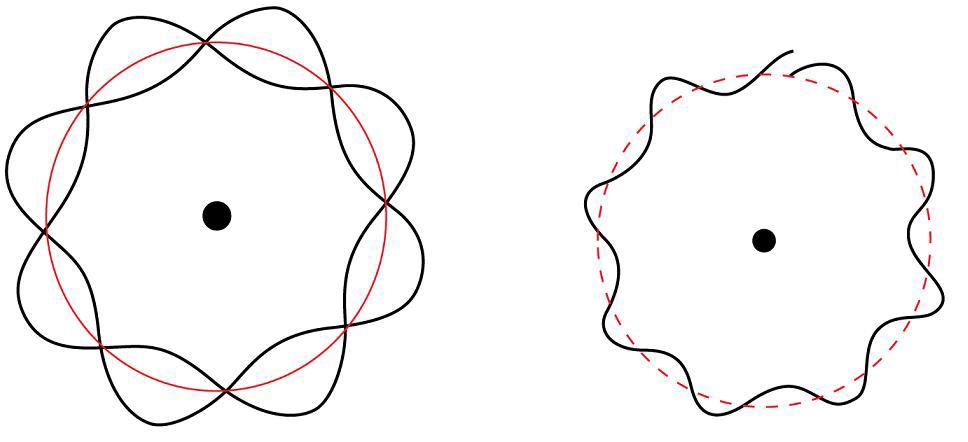
Bolj natančno merimo energijo ali položaj elektrona, manj vemo o drugem. Ne moremo natančno označiti položaja in momenta elektrona hkrati. To onemogoča napovedovanje poti za delce. Posledično je obnašanje elektrona opisano drugače kot obnašanje delcev normalne velikosti. Morate vedeti:
- Najpogostejši način za opisovanje elektronov v atomih v skladu s kvantno mehaniko je reševanje Schrödingerjeve enačbe za energetska stanja elektronov v tem oblaku.
- Ko je elektron v teh stanjih, je njegova energija jasno definirana in položaj ni.
- Položaj je opisan z zemljevidom verjetnostne porazdelitve, imenovanim orbitalno.
Trajektorijo, ki jo običajno povezujemo z makroskopskimi predmeti, nadomeščamo z elektroni v oblaku elektronov, statistični opisi pa ne kažejo na pot, temveč na območje, v katerem se nahaja. Ker kemikalija v atomskem elektronskem oblaku določa elektron, za razumevanje kemije je potrebno opisati konfiguracijo elektronov v ključu kvantno-mehanskega modela atoma.
Heisenbergov princip negotovosti: območje znotraj atoma
Louis de Broglie je predlagal, da se lahko vsi delci obravnavajo kot materialni valovi z valovno dolžino - lambda, definirano z naslednjo enačbo:
Lambda = dejanski čas (ura) + milivoltna ura
Erwin Schrödinger je predlagal kvantno-mehanski model atoma. Na kratko: elektrone obravnava kot valove snovi.
Kvadrat valovne funkcije predstavlja verjetnost iskanja elektrona v dani regiji znotraj atoma. Atomska orbita je definirana kot regija znotraj atoma, kjer je elektron.
Heisenbergov princip negotovosti navaja, da ne moremo poznati niti energije niti položaja elektrona. Torej, ko smo izvedeli več o položaju elektrona, vemo manj o njegovi energiji in obratno. Elektroni imajo lastno lastnost, imenovano spin. Vsaka dva elektrona, ki zasedeta isto orbito, morata imeti nasproti obrnjena.
Ad
Svetlobni eter v kvantnem svetu
Narava svetlobe je bila predmet raziskav že od antike. V 17. stoletju je Isaac Newton izvajal poskuse z lečami in prizmi. Uspelo mu je dokazati, da bela svetloba sestoji iz posameznih barv mavrice, združenih skupaj. Newton je razložil rezultate svoje optike s "corpuscular" pogledom na svetlobo, v kateri je svetloba obsegala tokove izjemno majhnih delcev, ki se gibljejo pri visokih hitrostih v skladu z Newtonovimi zakoni gibanja. Vredno omeniti:
Christian Huygens je pokazal, da so optični pojavi, kot so refleksija in lom, lahko enako dobro razloženi z vidika svetlobe kot valov, ki se gibljejo z visoko hitrostjo skozi medij, imenovan »svetlobni eter«. Prežema ves prostor.
Ad
Na začetku devetnajstega stoletja je Thomas Young pokazal, da svetloba, ki prehaja skozi ozke, tesno razporejene reže, ustvarja interferenčne vzorce, ki jih ni mogoče razložiti z vidika newtonskih delcev, vendar jih je mogoče z lahkoto interpretirati z vidika valov.
- Kasneje, v devetnajstem stoletju, potem ko je James Clerk Maxwell razvil svojo teorijo elektromagnetnega sevanja in pokazal, da je svetloba vidni del velikega spektra elektromagnetnih valov, je pogled delcev na svetlobo popolnoma diskreditiran.
Danes se ta področja imenujejo klasična mehanika in klasična elektrodinamika (ali klasični elektromagnetizem).
Kako je napredovala ideja o uvedbi novih konceptov v fiziki

Do konca devetnajstega stoletja so znanstveniki videli, da je fizično vesolje približno sestavljeno iz dveh ločenih področij:
- snov, ki nastane iz delcev, ki se gibljejo po Newtonovih zakonih gibanja;
- elektromagnetno sevanje, ki ga sestavljajo valovi, ki jih nadzirajo Maxwellove enačbe.
Paradoksi so privedli do moderne strukture kvantno-mehanskega modela Schrödingerjevega atoma, ki tesno povezuje delce in valove na temeljni ravni, ki se imenuje dvojnost valovnega delca, ki je nadomestil klasični pogled.
Diskretni Bohrov val: kako se obnašajo emisijski spektri vodika
Po Bohrovem modelu emisijski spektri različnih elementov vsebujejo diskretne linije. Vidno območje emisijskega spektra vodika lahko predstavimo s pomočjo tabele.
Ad
| Osnovno kvantno število | Število podravnih | Število elektronov |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 18 |
| 4 | 4 | 32 |
To je shematska predstavitev kvantov, kjer je znano število elektronov in nivojev. V življenju v vakuumskih pogojih ni mogoče z gotovostjo trditi, da obstaja omejitev na podravnih ravneh, vendar ne sme biti več kot 7. Kvantizirani emisijski spektri so pokazali, da lahko elektroni znotraj atoma obstajajo le pri določenih atomskih polmerih in energijah.

Z izdelavo modela je Bohr izpeljal enačbo, ki je pravilno napovedala različne ravni energije v atomu vodika. Kvantno-mehanski model je bil primeren le za predstavitev tega primera. Ravni ustrezajo emisijskim linijam v spektru snovi.
Bohrov model, ki je dokazal, da so sistemi z enim elektronskim vodikom
Hitrost elektronov pri energijski ravni osnovnega stanja vodika je 2,2 × 10 6 s ÷ m, pri čemer je s dolžina, m masa. Lahko nadomestimo konstanto, pa tudi maso in hitrost elektronov v de Brogliejevo enačbo. Hkrati pa ni mogel razložiti elektronske strukture v atomih, ki so vsebovali več kot en elektron.
Če se obrnemo na kemijo, mora kvantno-mehanski model vodikovega atoma vsebovati samo protone. Ko se srečamo z elektroni ali nevtroni, se delci začnejo obnašati kot val. V drugih primerih se lahko atomi druge snovi, ne glede na strukturo, obnašajo kot valovi ali delci. Na kratko, kvantno-mehanski model vodikovega atoma je materialni dualizem vala, vendar ne delcev.
Preklapljanje valov eden na drugega: kako se poti presajanja atomov ne mešajo
Radijski valovi iz mobilnega telefona, rentgenski žarki, ki jih uporabljajo zobozdravniki, energija, porabljena za kuhanje v vaši mikrovalovni pečici, sevalna toplota iz vročih predmetov in svetloba s televizijskega zaslona so vse oblike elektromagnetnega sevanja, ki kažejo valovitost. Ne pozabite:
- Val je nihanje ali periodično gibanje, ki lahko prenese energijo iz ene točke prostora v drugo.
- Tresenje konca vrvi prenaša energijo iz vaše roke na drugi konec vrvi; prodnik, ki pade v ribnik, vodi do širjenja valov vzdolž površine vode; širjenje zraka, ki spremlja strelo, ustvarja zvočne valove (grom), ki lahko potujejo več kilometrov.
- V vsakem od teh primerov se kinetična energija prenaša skozi snov (vrv, voda ali zrak), medtem ko snov ostane na svojem mestu.
Valov ne sme biti omejen na potovanje skozi materijo. Kot je pokazal Maxwell, so elektromagnetna valovanja sestavljena iz električnega polja, ki niha v času s pravokotnim magnetnim poljem. So pravokotne na smer gibanja. Ti valovi lahko preidejo v vakuum pri konstantni hitrosti 2.998 × 108 m / s, kjer je c hitrost svetlobe.