Le Chateliejevo načelo v kemiji
V nekaterih primerih snovi, ki nastanejo pri reakciji, bodisi medsebojno vplivajo bodisi razpadejo in nato se v sistemu pojavijo dve reakciji: neposredni (nastanejo reakcijski produkti) in obratno (začetne snovi so na novo sintetizirane). V primeru sovpadanja stopenj neposrednih in inverznih procesov v obravnavanem sistemu se pojavi ravnotežje, ki se imenuje kemično. To je dinamično ravnovesje, saj se reakcija ne ustavi, ampak se istočasno oblikuje in razgradi enaka količina snovi. S konstantno temperaturo in tlakom lahko ta situacija traja že kar nekaj časa. V grafični obliki je predstavljena spodaj. Z enakovredno hitrostjo je mišljena določena konstanta, ki je hkrati enaka hitrosti neposredne in povratne reakcije.
Ad
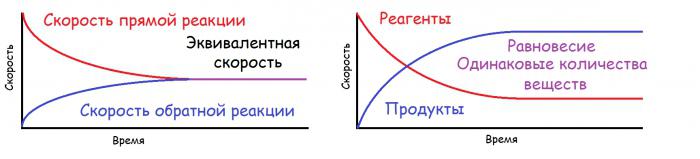
Načelo pristranskosti kemičnega ravnovesja
Načelo premika (premika) ravnotežja je odkril Le Chatelier leta 1884. Kasneje ga je povzel Karl Ferdinand Brown (1887). Zato ima zdaj dvojno ime - načelo Le Chatelier-Brown. Ta zakon se uporablja v kemiji in termodinamiki, elektrodinamiki, ekologiji in biokemiji. Obstaja veliko formulacij, vendar se bistvo vsakega od njih nanaša na naslednje: »Kadar je vpliv na sistem v ravnotežju, se kemijsko ravnotežje premakne, da bi nadomestilo to spremembo (tj. Sistem bo poskušal ponovno vzpostaviti ravnotežje) ". Opisano načelo je mogoče jasno prikazati z naslednjim sistemom. Na fiksno podporo je pritrjena vzmet. V mirovanju je ta sistem v ravnovesju. Če se vzmet raztegne, se bo ravnotežje preusmerilo v zunanji vpliv. Vendar pa sistem prav tako povečuje nasprotovanje. In v določenem trenutku postanejo sile opozicije in zunanji vplivi medsebojno enakovredne, zaradi česar nastane novo ravnovesno stanje.
Ad
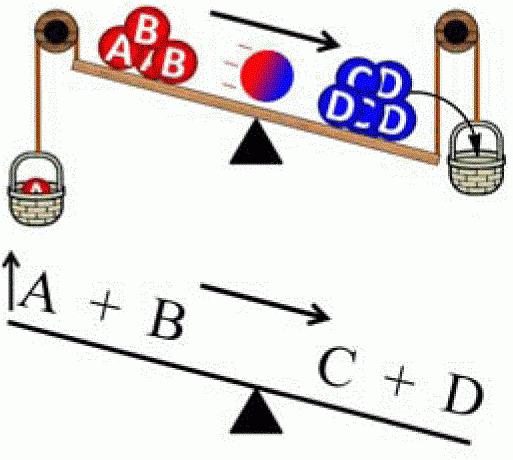
Načelo Le Chatelierja se lahko uporablja samo za sisteme v ravnovesju, sicer bodo rezultati analize napačni. Obstajajo trije glavni parametri, katerih sprememba povzroči premik v kemičnem ravnotežju: tlak, temperatura in koncentracija kemikalij.
Temperatura
Sprememba temperature je najpogostejši vzrok kemičnega ravnotežnega premika, kar je razumljivo, ker je ta dejavnik veliko lažje vplivati kot, na primer, tlak. Tu je treba omeniti, da so reakcije s toplotnim učinkom razdeljene na dva tipa. Med njimi so: eksotermne (z vročino) in endotermne (z njegovo absorpcijo). Kako se bo v tem primeru spremenilo kemijsko ravnovesje? Načelo Le Chatelier se v tem primeru zniža na naslednje: z naraščajočo temperaturo se ravnotežje premika proti reakciji, ki poteka z absorpcijo toplote, in ko se zmanjšuje v nasprotni smeri. Torej, če za reakcijo, prikazano spodaj, dvignete temperaturo, se bo ravnotežje premaknilo na desno stran.
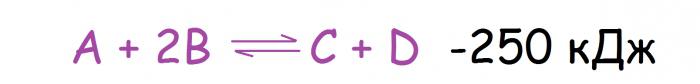
Večina neposrednih reakcij je eksotermnih in povratne reakcije so endotermne (to ni pravilo, ampak opazovanje, iz katerega je mogoče najti številne izjeme).
Pritisk
S spremembo tlaka se spremeni naslednji parameter sistema - njegova prostornina (poveča ali zmanjša), tako da učinek uporabe tega parametra še posebej močno vpliva na sisteme, v katerih so prisotni plini. V tem primeru je načelo kemijsko ravnovesje je naslednja. Če se tlak v sistemu poveča, se ravnotežje premakne v smeri zmanjšanja števila plinskih molekul, in ko se tlak zmanjša, se ravnotežje premakne v nasprotno smer. Če se število molekul plina med reakcijo ne spremeni, se ravnotežje ne spremeni, saj se tlak spremeni, kot na primer pri naslednji reakciji.
Ad
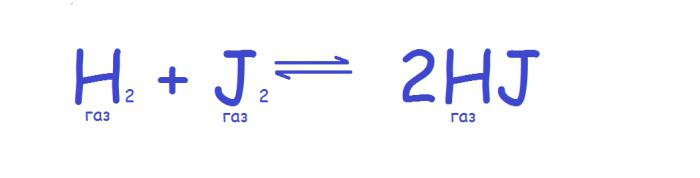
Vendar je v praksi to načelo veljavno le za idealne pline, saj imajo vsi realni različni stisljivost. Torej, tudi če število plinskih molekul ostaja nespremenjeno, je lahko ravnotežje odvisno od tlaka. V praksi bo to opazno, ko visok tlak. V primeru tekočih in trdnih snovi sprememba tlaka dejansko ne vpliva na ravnovesje zaradi majhnih količin, ki jih zasedajo take snovi. Pri mešanih sistemih se upoštevajo samo plinske molekule.
Ravnotežni premik v sistemu, ki je posledica sprememb koncentracije katere koli snovi v reakciji
Pri spreminjanju koncentracije snovi načelo Le Chatelier deluje na naslednji način. S povečanjem koncentracije reakcijskih produktov se ravnotežje premakne v obratno reakcijo in se z zmanjšanjem količine nastalih snovi ravnotežje premakne v nasprotno smer.
Ad
Kaj se zgodi, če dodamo inertni plin
Volumen sistema lahko spreminjate ne samo s stiskanjem ali slabljenjem tlaka, ampak tudi z dodajanjem inertnega plina, ki ne bo reagiral. Kaj se bo zgodilo s sistemom, ko mu bo dodan helij? Pravzaprav se najverjetneje ne bo nič zgodilo, saj se razmerje med snovmi, ki so vključene v reakcijo, ne bo spremenilo, proces pa ni pomemben za celotni tlak sistema, ampak za del vsake komponente.
Učinek katalizatorjev
Količina katalizatorja in njegova prisotnost na splošno ne vplivata na premik kemičnega ravnovesja. To se dogaja glede na dejstvo, da ta element enako pospešuje tako neposredno kot obratno reakcijo in ohranja ravnotežje v sistemu nespremenjeno.
Način preučevanja kemijskega ravnovesja
Podrobno obravnavanje kemijskega ravnovesja je zelo pomembno za popolno razumevanje procesa. Ena najpogosteje uporabljenih tehnik je tako imenovana metoda ravnotežnega zamrzovanja. Torej je hiter hladilni sistem v uravnoteženem stanju. Ravnotežje preprosto nima časa za premik in pri nizkih temperaturah se hitrost večine procesov upočasni na skoraj nič. Zaradi tega je možno popolnoma analizirati sestavo zmesi pri kateri koli temperaturi (koncentracija snovi, vključenih v reakcijo, pri nič stopinjah, bo ustrezala številu komponent pri temperaturi, pri kateri se je začelo zniževanje). Ta izkušnja se večkrat izvaja z reakcijami v obeh smereh.
Ad
Ali obstaja popolna nepopravljivost?
Kemijsko ravnovesje ni mogoče popolnoma prestaviti v eno smer. Tudi z navideznim absolutnim premikom bo vedno prisotno majhno število molekul, ki bodo reagirale.

V praksi so praktično vse reakcije reverzibilne in koliko bo ta učinek viden, je pogosto odvisen od temperature (pogosto je ravnovesje preprosto močno premaknjeno v eno smer, tako da postane opazno šele, ko se pogoji spremenijo). To je zaradi te prevalence reverzibilne kemijske reakcije preučevanje ravnovesja je še posebej pomembno.
Primeri sintez, pri katerih se kemijska ravnotežja premikajo med proizvodnjo
V proizvodnji se kemijsko ravnovesje običajno premakne v smeri neposredne reakcije, da dobimo reakcijske produkte. Obstaja veliko primerov takšnih sintez: pridobivanje amoniaka žveplov oksid (VI), dušikov oksid (II) itd.