Vodikov oksid: opis snovi, pripravek, lastnosti
Kakšna je kisikova spojina vodika? Oksid tega elementa ima določene fizikalne in kemijske lastnosti. Poskusimo razumeti dvojnost značilnosti te spojine in identificirati njene posebnosti.

Opredelitev
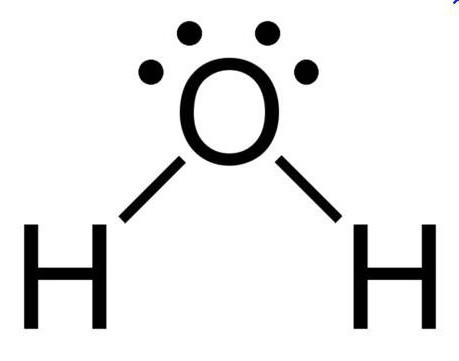
Najpomembnejša in najpogostejša snov na našem planetu je kisikova spojina vodika. Oksid nam je znan kot navadna voda. Težko si je predstavljati kakšno drugo spojino, ki ima enak pomen za žive organizme. Oksidi se imenujejo binarne spojine, ki vključujejo kisik. Pomemben pogoj za to je lokacija kisika na koncu kemijske formule.
Razvrstitev
Trenutno obstajajo tri skupine oksidov. Glavne so kisikove spojine, ki jih tvorijo kovine z nizko valenco (eno ali dve). Kot izjema od splošnega pravila se lahko upoštevajo berilij in cinkovi oksidi. Kljub temu, da je valenca teh kovin enaka dvema, se nanašajo na njihove kisikove spojine amfoterni oksidi. Značilnost amfoternih spojin je njihova interakcija s kislinami in alkalijami. Dvojne lastnosti so prikazane tudi z oksidi kovin, ki imajo valenco treh.
Kislinski oksidi tvorijo ne-kovine, kot tudi kovine z valenco od štiri do sedem. Katera skupina je vodikova spojina? Oksid tega elementa ima dvojne kemijske lastnosti, zato velja za amfoterno spojino.

V laboratorij
Redukcija oksidov z vodikom je eden od načinov pridobivanja vode. Ta postopek se uporablja v industriji za predelavo odpadnih kovin, iz njih pa se sproščajo železne in neželezne kovine. Hidrogeniranje se nanaša na toplotni in katalitični proces, katerega eden od proizvodov je tekoča voda.
Razširjenost v naravi
Ali ta narava narave obstaja v naravi? Oksid tega nekovine je v plinastem stanju sestavo zraka je v trdnem stanju v ledenikih. Tekoča oblika tega oksida je navadna voda, s katero je vsakdo seznanjen. Pravzaprav se ta oksid šteje za najpogostejšo snov na Zemlji, ki zagotavlja pretok vseh bioloških in kemičnih procesov, ki se pojavljajo v divjih živalih.

Fizikalne lastnosti in strukturne značilnosti
V normalnih pogojih je voda brezbarvna, brez okusa in tekočine brez vonja. Ta snov se šteje za odlično polarno topilo, zato se številni procesi pojavljajo prav v vodnem mediju. Vrelišče je 100 stopinj. Pri ničelni temperaturi voda postane led. Ta spojina ima dipolno strukturo, kar lahko pojasnimo z značilnostmi molekule. Ker dva elektronska para ostajata neuporabljena v kisiku, v sp3 oksidu hibridno stanje ima atom kisika, valenčni kot je 110 stopinj.
Kemijske lastnosti
S katerimi snovmi reagira vodikov oksid? Kemijska enačba, ki odraža reakcijo med vodo in kislinskimi oksidi, pomeni tvorbo kislin. Izjema od splošnega pravila je silicijev oksid - ne reagira z vodikovim oksidom. Enačba reakcije med kisikovo spojino aktivne kovine in vode je predstavljena v obliki: CaO + H 2 O = Ca (OH) 2
Končni produkt te interakcije je alkalija.
Poleg reakcij z oksidi lahko voda reagira tudi s kovinami. Alkalijske kovine (brez segrevanja) tvorijo alkalije in nastaja tudi vodikov plin.
Kovine s srednjo aktivnostjo (pri segrevanju) tvorijo oksid in vodik v reakciji z vodo. Nizkoaktivne kovine, ki se nahajajo v elektrokemični seriji napetosti kovin po vodiku, ne morejo vplivati na vodo.
Zaporedje laboratorijske proizvodnje vode lahko predstavimo takole: vodikov oksid. Reakcija, ki se zgodi v tem primeru, je eksotermna in jo spremlja sproščanje velike količine toplotne energije. Končni proizvod je vodikov oksid. Reakcijska enačba ima obliko: 2H2 + O2 = 2H2O
Dipolna struktura vodne molekule pojasnjuje možnost nastanka vodikovih vezi kovalentne narave s to anorgansko spojino. Ta spojina ima najvišjo vrednost toplotne prevodnosti, zato je voda snov, ki se uporablja v sistemih ogrevanja. 
Biološki pomen
Nemogoče si je predstavljati življenje osebe brez vode. To univerzalno topilo ni potrebno le v kemijskem laboratoriju. Vsak drugi kompleksni biokemični procesi se odvijajo v živih bitjih. Voda ni le aktivna udeleženka v številnih sintezah, ampak deluje tudi kot stranski produkt mnogih izmed njih. V šestdesetih letih svojega obstoja človek skozi svoje telo preide okoli 50 ton te edinstvene anorganske snovi.
Vodikov oksid je našel uporabo na številnih področjih industrijske človeške dejavnosti. Ta spojina je nepogrešljiva v medicini, v povpraševanju v kmetijstvu.
V elektroenergetskem sistemu je na primer opisana kemična spojina delovna tekočina in glavna hladilna tekočina. Električne postaje na njej porabijo do 40 kubičnih metrov vode na sekundo. Na primer, za popolno hlajenje kondenzatorja turbine potrebujete do deset tisoč kubičnih metrov vodikovega oksida. V metalurški industriji se voda uporablja kot hladilna snov za glavno opremo, uporabljajo pa se tudi njene fizikalne lastnosti, kot je visoka toplotna prevodnost.
V kemični industriji je to povpraševanje kot dobro topilo, kot tudi odlično vozilo za premikanje reagentov iz enega tehnološkega izdelka v drugega.
Upoštevajte, da se umik tekočih industrijskih odpadkov izvaja tudi v obliki suspenzij in emulzij. Težko je zanesljivo oceniti tiste količine vodikovega oksida, ki se nanašajo na gospodinjske in industrijske potrebe.
V medicini je voda odlično topilo, snov za higieno in sanitacijo, zdravilo. Zagotavlja prenos hranil v rastline, je aktivni udeleženec v fotosintezi, regulator temperature živih bitij. V vsakdanjem življenju je ta kemična spojina nujna tako za kuhanje kot za odstranjevanje odpadkov iz človeškega izvora. Zato je tako pomembno, da pitna voda, ki jo uporabljajo ljudje, izpolnjuje vse zahteve in ne vsebuje nečistoč, ki so škodljive za zdravje ljudi.
Mimogrede, med številnimi bitji, ki živijo na našem planetu, samo virusi ne potrebujejo vode.