Osmotski pritisk v naravi in človeškem življenju
Gradivo, predloženo v pregled, bo zagotovilo informacije o osmotskem tlaku (g). V nadaljevanju bomo obravnavali: formulacijo izraza, značilnosti in lastnosti, metode merjenja tlaka, odnos z biologijo in odnos do rešitev (pp) različnih vrst.
Poznavanje osmotskega tlaka
Osmotski tlak je presežek hidrostatskega tlaka na raztopine. Hkrati je treba same raztopine ločiti s polprepustnim membranskim tipom iz čistih topil. Proces raztapljanja skozi membrano v takih pogojih ne pride. Namen tega pritiska je prizadevanje za ustvarjanje enakega ravnovesja med koncentracijami katere koli raztopine, sredstvo pa je sestavljanje molekularne difuzije med topno in topilo. Osmotski tlak je označen s črko "π" (pi).
O lastnostih
Osmotski tlak ima fenomen toničnosti, ki je gradientno merilo osmotskega tlaka. Z drugimi besedami, to je potencial razlike vode v paru p-jarka, ki je ločen s polprepustno membrano. Hipertonična raztopina ime snovi, ki ima v primerjavi z drugo raztopino višji osmotski tlak. Nasprotno, hipotonična raztopina ima nižji osmotski indeks.
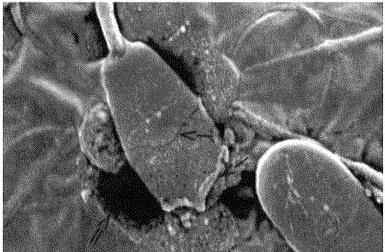
Če je takšna raztopina v zaprtem prostoru, na primer v krvni celici, bomo videli, da se lahko osmotski tlak zlomi. celične membrane. Zdravila, ki se vnesejo v kri, se najprej pomešajo z izotoničnim p-rumom, zaradi česar se raztopijo prav zaradi tega razloga. S tem natrijev klorid V raztopini mora biti količina, ki je sposobna uravnotežiti osmotski učinek celične tekočine.
Če bi bila zdravila, ki se dajejo, narejena na osnovi vode ali zelo razredčenih raztopin, bi osmotska razgradnja zlomila krvne celice tako, da bi v njih prodrla voda. Ustvarjanje rešitev z uporabo previsokih koncentracij snovi bo prisililo vodo, da zapusti celice, zaradi česar se bodo krčile. Za to je dovolj od tri do deset odstotkov natrijevega klorida v p-re.
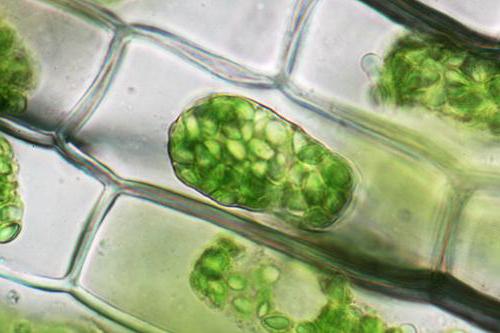
Rastlinske celice, za razliko od živali, bodo izpostavljene ločitvi od celične stene, vse njene vsebine, razen zunanje celične stene, vendar skupaj z membrano. Ta pojav imenujemo plazmoliza. Deplazmolizom pa je proces, ki ga opazimo pri premikanju skrčenih celic v pp bolj razredčenega tipa.
Razmerje med tlakom in raztopino
Kemijska narava raztopin v spojini ne vpliva na velikost osmotskega učinka. Njegova stopnja je odvisna od količine teh snovi v p-re. Zato vidimo, da je osmotski tlak koligativna lastnost raztopine. Tlak se bo povečal s povečanjem koncentracije aktivnih snovi v p-re. To kaže zakon osmotskega tlaka. Formula je preprosta:
π = i · C · R · T ,
kjer izotonični koeficient je označena s črko i , molarna raven koncentracije p-ra je izražena s C (mol / m 3 ), univerzalni plinski indeks njegove konstante je označen s črko R, T pa je termodinamična raven p-ra temperature.
Formula je podobna zakonu o idealnem plinu. Delci v zraku popoln plin v topilnem mediju viskoznega tipa podobnosti v njihovih lastnostih kažejo tudi na njihove skupne lastnosti. Ta izjava potrjuje številne poskuse, ki jih je izvedel J. B. Perrin leta 1906. Opazoval je proces razdeljevanja delcev emulzije gummigovoj smole v vodnem stolpcu, ki se je praviloma držal Boltzmannovega zakona.
Obstaja koncept oncotičnega osmotskega tlaka, ki je odvisen od količine beljakovin v raztopini. Zaradi stradanja ali bolezni ledvic se bo koncentracija beljakovin zmanjšala. Zaradi tega bo padel onkotski tlak in začeli se bodo pojavljati edemi onkotske narave. Prenesena bo voda iz tkiv v žile, na mesta, kjer je π onc več Gnojni procesi povzročajo povečanje π onc dva do trikrat. To je posledica uničenja beljakovin, kar vodi do povečanja števila delcev.
Stabilen osmotski indeks mora biti približno 7,7 atm. Zato izotonične raztopine običajno vsebujejo približno π plazme = 7,7 atm. Rešitve s π presega π plazme , Uporablja se za odstranjevanje gnojev iz ran ali za odpravo alergijskega edema. So tudi laksativna zdravila.
Termodinamični pogled na osmotski tlak
Vant-Hoffova formula, ki se uporablja za osmotsko zdravljenje, se lahko utemelji s termodinamičnega vidika.

Prosta energija, ki je v raztopini, bo ustrezala G = G 0 + RTlnx A + π V C. Molarni del raztopine bo označen kot x A , V C - to je indikator molarne prostornine. Izraz πV C je enak vnosu proste energije zunanjega tlaka. Čisto topilo ima G = G0 . Če ravnovesni indeks G topila ustreza indikatorju 0, dobimo:
0 = = G = G 0 + RTlnx A + π V C - G 0 = RT lnx A + π V C.
Rezultat zapis se lahko pretvori v formulo van't Hoff.
O koloidnih raztopinah
Osmotični tlak raztopine se lahko pojavi, če sta prisotna dva pogoja:
- Potrebna je polprepustna stena (membrana).
- Prisotnost dveh raztopin na obeh straneh membrane, raztopine pa morajo biti različnih koncentracij.
Celična membrana lahko prehaja delce specifičnih velikosti, npr. Dovoli in sprosti vodno molekulo, vendar ima nasproten učinek na C2H6O. Tako lahko z uporabo posebnih materialov, ki imajo tudi takšno možnost ločevanja, ločimo različne sestavine zmesi.
Osmotske rešitve se izračunajo s π = cRT. To formulo je izpeljal Vant-Hoff leta 1885, Pfefferjevi poskusi s poroznim porcelanom pa so bili osnova za njegovo ugotovitev.
Turgor v kletki
Tako osmoza kot osmoza sta zelo pomembni sestavini mnogih bioloških sistemov. Če struktura vsebuje polprepusten septum (specifično tkivo ali celično steno), bo konstantna stopnja osmoze vode povzročila preveč hidrostatičnega tlaka, zaradi česar se bo oblikoval turgor, ki bo zagotovil moč in odpornost tkiv.
Morda fenomen hemolize, ki je razpok celične membrane, kot je eritrocit zaradi prekomernega otekanja, ko je postavljen v prečiščeno vodo.
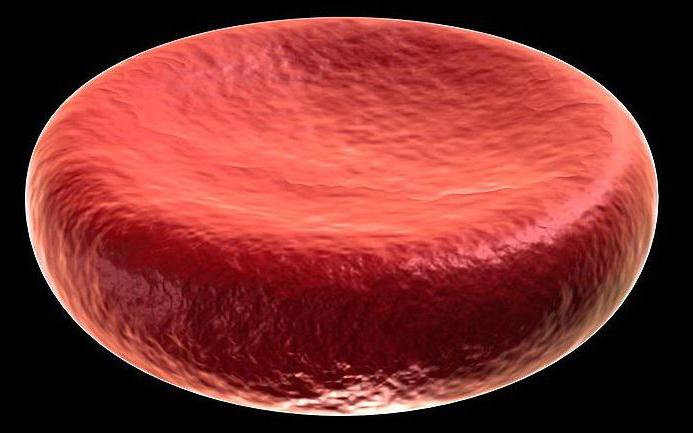
Plazmoliza
Nasprotni procesi se bodo pojavili, ko bo celica nameščena v raztopini soli koncentriranega tipa: voda, ki jo vsebuje celica, bo skozi membrano difundirala v raztopino soli. Posledično se bo celica skrčila in izgubila turgor stabilnega stanja. Ta pojav imenujemo plazmoliza. Turgor pa lahko obnovimo tako, da plazmolizirano celico postavimo v protoplazmatsko vodo. Volumen celice se ohrani samo v izotoničnem p-re z isto koncentracijo (konstantno osmotsko).
Povzamemo
Ta material je bralcu omogočil, da se je seznanil s konceptom osmotske obdelave, oblikoval splošno idejo o njem in se naučil veliko zanimivih stvari. Na primer, podobnost izračuna formule z Van't Hoffovo formulo, podobnost z idealnim plinom, vloga v bioloških procesih in posledice, ki jih lahko povzročijo, in sicer turgor, plazmoliza, hemoliza in še veliko več.