Dušikov oksid: formula, lastnosti, uporaba
Oksidi se imenujejo binarne spojine kemijskih elementov z atomom kisika, v katerem je oksidacijska stopnja 2-. Dušik, ki ima nižjo elektronegativno vrednost, tvori različne kombinacije s kisikom. Te spojine spadajo v različne razrede snovi. Dušikov oksid vsebuje kisik v količini, ki določa valenco elementa N. Je od 1 do 5.
Kaj so oksidi
Obstaja približno ducat dušikovih spojin, ki vsebujejo O-element. Med temi petimi najpogostejšimi so monovalentni oksid, dvovalentni oksid, železov oksid, tetravalentni oksid in pentavalentni oksid. 
Preostale spojine veljajo za manj pogoste. Ti vključujejo tetravalentni dušikov oksid v obliki dimera, nestabilne molekule nitrilazida, nitrozil azida, trinitramida in nitratnega radikala.
Formule dušikovih oksidov
Spodaj so označbe najpomembnejših spojin elementa N.
To je predvsem dušikov oksid, katerega formula je sestavljena iz dveh kemijskih znakov - N in O. Indeksi so postavljeni za njimi, odvisno od oksidacijska stanja atomov.
- Monovalentni dušikov oksid ima formulo N2O. V njem je N atom nabit +1.
- Dušikov oksid ima formulo NO. V njem je N atom napolnjen +2.
- Dušikov železov oksid ima formulo N2O3. V njem je N atom napolnjen +3.
- Tetravalentni dušikov oksid, katerega formula je NO2, ima naboj N + 4 atoma.
- Pentavalentna kisikova spojina je označena kot N2O5. V njem je N atom napolnjen +5.
Opis monovalentnega dušikovega oksida
Imenujejo se tudi diazo, dušikov oksid in plin za smeh. Priimek prihaja iz dejanja, povezanega z zastrupitvijo. 
Dušikov oksid z valenco I pri normalnih temperaturnih pogojih obstaja v obliki negorljivega plina, brez barve, ki ima prijeten sladkast okus in vonj. Zrak je lažji od te spojine. Oksid je topen v vodnem mediju, etanolu, etrih in žveplovi kislini.
Z vodo, alkalnimi in kislinskimi raztopinami ni mogoče reagirati, ne tvorijo soli. Ni predmet vžiga, vendar lahko podpira proces zgorevanja.
Amonijev dušikov oksid se pretvori v azid (N3NH4).
V kombinaciji z molekulami etrov, kloroetana in ciklopropana se tvori eksplozivna zmes.
Običajni pogoji prispevajo k njegovi inerciji. Pod vplivom ogrevanja se snov ponovno vzpostavi.
Opis oksida dvovalentnega dušika
Imenuje se tudi monoksidni, oksidni ali nitrozilni radikal. V normalnih temperaturnih pogojih je brezbarven, nevnetljiv plin, rahlo topen v vodnih medijih. Zrak se oksidira, izkaže se NO 2. Njegova tekoča in trdna oblika postane modra. 
Dušikov oksid je lahko redukcijsko sredstvo v interakcijah s halogeni. Produkt njihovega dodajanja je nitrozil halid, ki ima formulo NOBr.
Žveplov dioksid in drugi močni reducenti oksidirajo NO in tvorijo N2 molekule.
Opis železovega oksida
Navedeni so kot dušikov anhidrid. V normalnem stanju je lahko tekočina modre barve, standardni parametri medija pa pretvorijo oksid v obliko plina, ki nima barve. Ima stabilnost le pri nizkih temperaturah.
N2O3 molekule disociirajo med segrevanjem z sproščanjem mono- in bivalentnega oksida.
Kot anhidrid doda vodo za proizvodnjo dušikove kisline in z alkalijami tvori soli v obliki nitritov.
Opis oksida tetravalentnega dušika
Na drug način se imenuje dioksid. Obstaja v obliki rjavo-rdečega plina, ki ima oster vonj in je lahko tudi rumenkasta tekočina. 
Nanaša se na kisle okside, ki imajo dobro razvito kemijsko aktivnost.
Njegove molekule oksidirajo nekovine z tvorbo spojin, ki vsebujejo kisik, in prostim dušikom.
Dioksid reagira s tetravalentnim in šestvalentnim žveplovim oksidom. Izkazalo se je žveplove kisline. Metoda njene sinteze se imenuje dušikova.
Dušikov oksid se lahko raztopi v vodnem okolju. Dušikova kislina je rezultat te reakcije. Ta proces se imenuje nesorazmernost. Vmesna komponenta se šteje za dušikovo kislino, ki se hitro razgradi.
Če raztopite dušik tetravalentni oksid v alkali, potem nastajanje raztopin nitratov in nitritov. Lahko uporabite njegovo tekočo obliko za interakcijo s kovino, nato pa dobite brezvodno sol.
Opis pentavalentnega dušikovega oksida
Nanaša se tudi na diazotični pentoksid, nitronijev nitrat, nitril nitrat ali dušikov anhidrid. 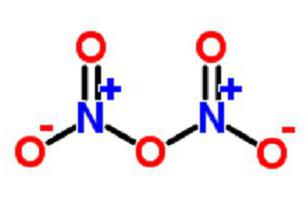
Je v obliki brezbarvnih kristalov, ki so hlapne in nestabilne. Njihovo stabilnost opazimo pri nizkih temperaturah. To strukturo tvorijo nitratni in nitritni ioni.
V plinasti obliki ima snov obliko anhidrida NO 2 –O - NO 2 .
Pentavalentni dušikov oksid ima kisle lastnosti. Z sproščanjem kisika se zlahka razgradi.
Snov reagira z vodo, kar povzroči nastajanje dušikove kisline.
Alkali raztopijo anhidrid s sproščanjem soli nitratov.
Kako priti do dušikovih oksidov
Kadar se v akutnem stanju uporablja suhi amonijev nitrat, nastane oksid N 2 O, vendar lahko to metodo spremlja eksplozija.
Prednostna metoda pridobivanja monovalentnega oksida je učinek dušikove kisline v koncentrirani obliki na sulfaminsko kislino. Glavni pogoj je ogrevanje.
Nitrozil, ali NO, je posebni dušikov oksid, ki ga dobimo z medsebojnim delovanjem molekul N 2 in O 2 . Pomemben pogoj za ta postopek je močno segrevanje nad 1000 ° C.
Naravna metoda pridobivanja je povezana z razelektritvijo v atmosferskem zraku. Tak oksid se hitro združi z molekulami kisika in nastane dioksid.
Laboratorijska metoda za sintezo NO je povezana z reakcijo kovin in nekoncentrirane dušikove kisline. Primer take reakcije je interakcija bakra s HNO 3 .
Drug način za tvorbo dušikovega monoksida je reakcija železovega klorida z natrijevim nitritom in klorovodikovo kislino. Rezultat tega procesa je železovo železo in natrijevi kloridi, voda in sam oksid.
V industrijskem merilu se proizvaja z oksidacijo molekul amoniaka med segrevanjem in pod visokim tlakom. Pospeševalnik procesa je platina ali krom trivalentni oksid. 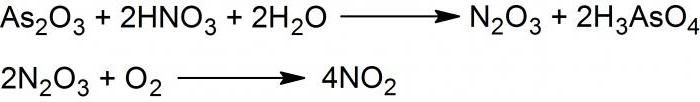
Dioksid ali NO2 dobimo z reakcijo arzena trivalentnega oksida s 50% dušikovo kislino, ki se po kapljicah nanese na površino trdnega reagenta. Nastane zmes oksidov dvovalentnega in tetravalentnega dušika.
Če se ohladi na temperaturo -30 ° C, potem se sintetizira dušikov anhidrid ali N2O3.
V obliki prahu dobimo v primeru prehoda električnega toka skozi njegovo plinasto obliko.
Če se na škrobni prah ravna z dušikovo kislino s koncentracijo 50%, se sprosti oksid divalentnega in tetravalentnega dušika, plin ogljikovega dioksida in voda. Kasneje se iz pridobljenih prvih dveh spojin tvori molekula N 2 O 3 .
Zaradi toplotne razčlenitve spojine svinčevega nitro, dušikov dioksid, prosti kisik in svinčev oksid.
Anhidrid ali N 2 O 5 nastane zaradi izločanja vodne molekule iz kisline z nitričnim delovanjem fosforjev oksid pentavalent.
Drugi način sintetiziranja je, da se skozi suh klorid prenese preko brezvodnega srebrovega nitrata.
Če na dušikovi dioksid vplivajo molekule ozona, se tvori N 2 O 5 .