Magnezijev hidroksid: opis snovi, lastnosti in uporaba
Magnezijev hidroksid je anorganska snov, je slabo topna spojina, ki povzroči nastanek oborine v vodnih raztopinah. Formula magnezijevega hidroksida je Mg (OH) 2 , to je dvo-kislinska baza. Bolj topen v vodi kot značilne netopne baze, vendar manj topen kot kalcijev hidroksid. Zato se imenuje slabo topne spojine.
Širjenje v naravi
Magnezijev hidroksid v naravi najdemo v obliki mineralnega brucita. Velike usedline te pasme so zelo redke. V Rusiji se koplje na odlagališču Kuldur, kjer so njegove rezerve ocenjene na 14 milijonov ton. Proizvodnja na njem poteka s hitrostjo okoli 250 tisoč ton proizvoda na leto, vendar se je od letošnjega leta obseg proizvodnje podvojil. Razlog za to je bilo dobro povpraševanje po tem mineralu v tujini. Največji uvoznik je Japonska.

Izgleda, kot so beli, sivi ali zelenkasto-beli kristali s steklenim sijajem na prelomu. Ima precej nizko trdoto, zato jo je enostavno rezati z nožem. Lahko vsebuje nečistoče. Glede na njihovo število in vrsto se razlikuje med različnimi podvrstami tega minerala. Tako ferronemalit poleg magnezijevega hidroksida vsebuje tudi 5% železa v obliki oksida, ferrobrusit pa že 36%. Železov oksid je rjave barve (rdeča barva), zato ti minerali pridobijo enak odtenek namesto običajne svetlo zelene barve. Obstaja tudi mangobrusite. Tu je nečistoča mangan. Ta mineral ima medeno rumeno barvo. Ob stiku s kisikom v zraku pa mineral hitro izgubi svojo čudovito barvo in se hitro pojavi.
Uporabite ta mineral predvsem kot surovine. Proizvaja oksidne in druge magnezijeve spojine, tokove in različne ognjevarne materiale. Toda brucit se lahko uporabi brez kakršne koli obdelave. Ta mineral se torej uporablja za čiščenje plinov iz klora in za sorpcijsko filtracijo vode.
Pridobivanje
Glavna reakcija pridobivanja netopnih hidroksidov je reakcija interakcije alkalij z magnezijevimi solmi. Na primer, pri interakciji magnezijevega sulfata z natrijevim hidroksidom. To je dobra ilustracija. In še en primer - v interakciji magnezijevega klorida in kalijevega hidroksida.
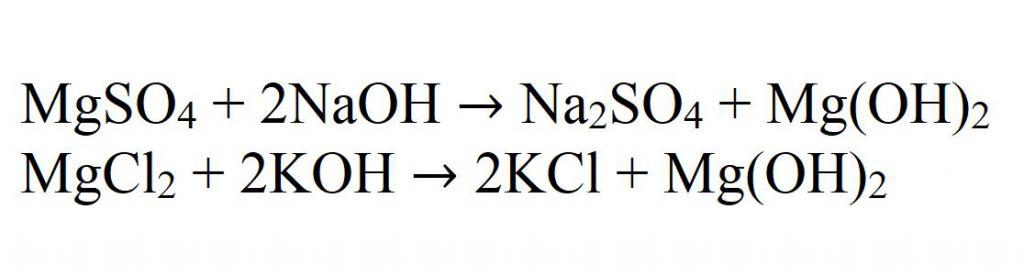
V ionski obliki so vse take reakcije zapisane kot:
Mg 2+ + OH - → Mg (OH) 2
Medsebojno delovanje magnezija ali njegovega oksida z vodo lahko proizvaja tudi hidroksid. Ta reakcija je zelo počasna in samo pri segrevanju.
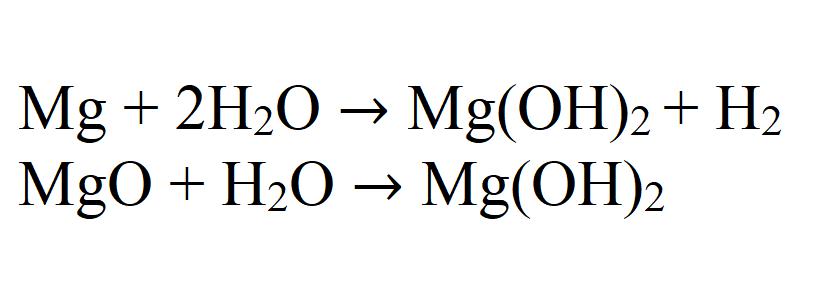
Obstaja tako pogost mineral - dolomit. S kemičnega stališča je mešanica kalcijevega karbonata in magnezija. Pri predelavi tega minerala z vodno raztopino magnezijevega klorida, ko se segreje, se netopni hidroksid obori:
MgCO3 · CaCO3 + 2H2O + MgCl2 → Mg (OH) 2 + CaCl2 + 2C02
Fizične lastnosti
V suhi obliki je magnezijev hidroksid bela kristalna snov. Ne vonja, ampak ima alkalni okus. Je rahlo topen v vodi (samo 0,6 mg na 100 ml vode). Toda kljub temu imajo njene vodne raztopine šibek alkalni medij in barve indikatorjev v ustreznih barvah. Toda ta spojina se raztopi v raztopinah amonijevih soli. Ne topi se, saj se pri temperaturi 480 o C razgradi na magnezijevem oksidu in vodi, kot vse druge netopne baze. Gostota pri normalnih pogojih: 2,4 g / cm3.
Kemijske lastnosti
Magnezijev hidroksid je tipična netopna baza. To določa njegove kemijske lastnosti. Na primer magnezijev hidroksid reagira s kislinami, kislinskimi oksidi in nekovinami:
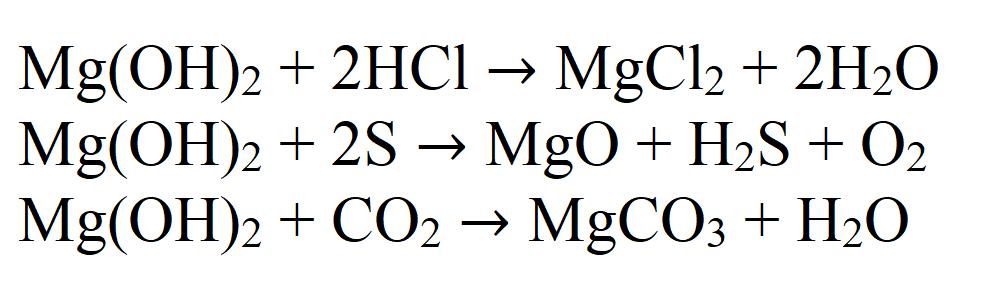
Zaradi slednje reakcije se nagiba k absorpciji ogljikovega dioksida neposredno iz zraka, da se tvori karbonat, zato ni priporočljivo, da je ta snov odprta dolgo časa.
Prav tako medsebojno deluje s solmi, če reakcija povzroči oborino ali plin:

Kot je navedeno zgoraj, se magnezijev hidroksid, ko je segret, razgradi po enačbi:
Mg (OH) 2 → H 2 O + MgO
Glede tvorbe kompleksnih spojin, kjer bi magnezijev kation deloval kot ligand, obstajajo nasprotujoče si informacije o tej točki. Nekateri viri kažejo, da magnezij ni nagnjen k njihovemu nastajanju in da so le nestabilne spojine z magnezijevimi halidi. Drugi viri kažejo, da lahko magnezijev hidroksid reagira z vročimi alkalijami in tvori hidromagnezate:
Mg (OH) 2 + 2NaOH → Na2 [Mg (OH) 4 ]
Medicinske aplikacije
V medicini so suspenzije na osnovi magnezijevega hidroksida uporabljene kot antacid. To omogočajo osnovne lastnosti. Ko pride v želodec, magnezijev hidroksid zmanjša kislost z nevtralizacijo klorovodikove kisline. Uporablja se za gastritis, razjedo na želodcu in razjedo na dvanajstniku. Zdravila, ki temeljijo na njej, ne zmanjšajo kislinsko-baznega ravnovesja in ne kršijo izločanja klorovodikove kisline. Toda tudi kljub temu, zdravilo ima številne omejitve in je kontraindicirana za ljudi s preobčutljivostjo za magnezijev hidroksid.
Produkt medsebojnega delovanja magnezijevega hidroksida in klorovodikove kisline v želodčnem soku je magnezijev klorid. Je močan odvajalec (delovanje se pojavi po 2-6 urah). Zato je magnezijev hidroksid aktivna sestavina nekaterih zdravil na tem področju. Presežek magnezija v telesu se z lahkoto izloči skozi ledvice, če pa oseba trpi za boleznimi teh organov, potem lahko v telesu dobi odvečne količine magnezija, ko jemlje zdravila (hipermagnezij).
Druga lastnost te spojine je sprostitev mišic. Včasih se pripravki, ki vsebujejo magnezijev hidroksid, predpisujejo ženskam, ki jim grozi spontani splav.
Uporaba v drugih panogah
Magnezijev hidroksid se v prehrambeni industriji uporablja kot dodatek E528. V izdelkih uravnava kislost in stabilizira barvo. Magnezijev hidroksid se uporablja tudi za vezavo žveplovega dioksida, katerega pojav je nezaželen v živilskih proizvodih. Uporablja se v proizvodnji konzervirane zelenjave, omak, kumaric in sira. Ta dodatek velja za neškodljiv, vendar je prepovedan v Avstraliji, Združenem kraljestvu in na Novi Zelandiji.
Prav tako se magnezijev hidroksid uporablja kot aditiv za zaviranje gorenja v polimerih (PVC, poliolefini), kot dodatek v detergentih in zobnih pastah, za rafiniranje sladkorja in čiščenje odpadne vode.
Oksid, pridobljen iz magnezijevega hidroksida, je zelo uporabna spojina. Lahko prenese temperaturo okoli 3000 stopinj, zato se uporablja kot ognjevarni material. Torej, se doda opeke, od katerih nato naredijo plavži. Za čiščenje naftnih derivatov uporabite magnezijev oksid in kot sorbent. Brusilna sposobnost te spojine je prav tako visoka. Čisti in polira površine delov v elektronski industriji.