Entalpija - kaj je to?
Kakšna je entalpija tvorbe snovi? Kako uporabiti to vrednost v termokemiji? Da bi našli odgovore na ta vprašanja, upoštevajte osnovne pojme, povezane s toplotnim učinkom kemijske interakcije.
Toplotni učinek reakcije
To je količina, ki je značilna toplote sprosti ali absorbira med medsebojnim delovanjem snovi.
Če se postopek izvaja v standardnih pogojih, se toplotni učinek imenuje standardni reakcijski učinek. To je standardna entalpija tvorbe reakcijskih produktov.
Toplotna zmogljivost procesa
To je fizikalna količina, ki določa razmerje med majhno količino toplote in spremembo temperature. J / K se uporablja kot enota za merjenje toplotne zmogljivosti.
Specifična toplota količino toplotne energije, ki je potrebna za povečanje temperature za stopnjo Celzija, za telo z maso enega kilograma.
Termokemični učinek
Za skoraj vse kemična reakcija Izračunate lahko količino energije, ki se absorbira ali sprosti med interakcijo kemičnih komponent.
Takšne transformacije se imenujejo eksotermne, zaradi česar se v ozračje sprosti določena količina toplote. Na primer, povezovalne procese označuje pozitiven učinek.
Entalpija reakcije se izračuna ob upoštevanju sestave snovi in tudi stereokemijskih koeficientov. Endotermne interakcije vključujejo absorpcijo določene količine toplote za začetek kemične reakcije.
Standardna entalpija je vrednost, ki se uporablja v termokemiji.
Spontani proces
V termodinamični sistem proces se spontano nadaljuje, ko se zmanjša prosta energija interakcijskega sistema. Kot pogoj za doseganje termodinamičnega ravnovesja upoštevamo minimalno vrednost termodinamičnega potenciala.
Samo če se konstantni zunanji pogoji ohranijo v času, lahko govorimo o neskladnosti interakcije.
Eden od delov termodinamike je natančno proučevanje ravnotežnih stanj, v katerih je entalpija vrednost, izračunana za vsak posamezen proces.
Kemični procesi so reverzibilni v primerih, ko se pojavijo hkrati v dveh obratnih obratnih smereh: obratno in naprej. Če opazimo obratni proces v zaprtem sistemu, bo sistem v določenem časovnem obdobju dosegel ravnovesno stanje. Zanj je značilno prenehanje sprememb koncentracije vseh snovi v času. Takšno stanje ne pomeni popolnega prenehanja reakcije med izhodnimi materiali, saj je ravnovesje dinamičen proces.
Entalpija je fizikalna količina, ki se lahko izračuna za različne kemikalije. Kvantitativna značilnost ravnotežnega procesa je konstanta ravnovesja, izražena z delnim tlakom, ravnotežnimi koncentracijami in molskimi deli interakcijskih snovi.
Pri vsakem reverzibilnem postopku se lahko izračuna ravnotežna konstanta. Odvisna je od temperature, kot tudi od narave komponent, ki delujejo.
Preučimo primer pojavljanja v sistemu stanja ravnovesja V začetnem trenutku v sistemu obstajajo samo začetne snovi A in B. Hitrost neposredne reakcije ima največjo vrednost in obratni proces se ne nadaljuje. Ko se koncentracija začetnih komponent zmanjša, opazimo povečanje hitrosti obratnega procesa.
Glede na to, da je entalpija fizikalna količina, ki jo je mogoče izračunati za reaktante, kot tudi za produkte procesa, lahko naredimo določene zaključke.
Po določenem časovnem intervalu je hitrost neposrednega procesa enaka hitrosti povratne interakcije. Konstanta ravnovesja je razmerje konstant hitrosti neposrednega in inverznega procesa. Fizični pomen te količine kaže, kolikokrat je hitrost neposrednega procesa večja od vrednosti povratne interakcije pri določeni koncentraciji in temperaturi.

Vpliv zunanjih dejavnikov na kinetiko procesa
Ker je entalpija vrednost, ki se uporablja za termodinamične izračune, obstaja razmerje med njo in pogoji procesa. Na primer, na termodinamično interakcijo vplivajo koncentracija, tlak, temperatura. Ko se ena od teh vrednosti spremeni, pride do ravnotežnega premika.

Entalpija je termodinamični potencial, ki označuje stanje sistema v ravnotežju, kadar ga izberemo v obliki neodvisnih spremenljivk entropije, tlaka, števila delcev.
Entalpija označuje raven energije, ki je shranjena v molekularni strukturi. Torej, če ima snov energijo, ni v celoti pretvorjena v toploto. Del je shranjen neposredno v snovi, potreben je za delovanje snovi pri določenem tlaku in temperaturi.

Zaključek
Sprememba entalpije je merilo toplote kemijske reakcije. Karakterizira količino energije, ki je potrebna za izmenjavo toplote pri konstantnem tlaku. Ta vrednost se uporablja v tistih primerih, ko so konstantne vrednosti v procesu tlak in temperatura.
Entalpija je pogosto označena kot celotna energija snovi, ker je definirana kot vsota notranje energije in delo, ki ga opravlja sistem.
V resnici ta količina deluje kot skupna količina energije, ki označuje energetske kazalnike snovi, ki se pretvori v toploto.
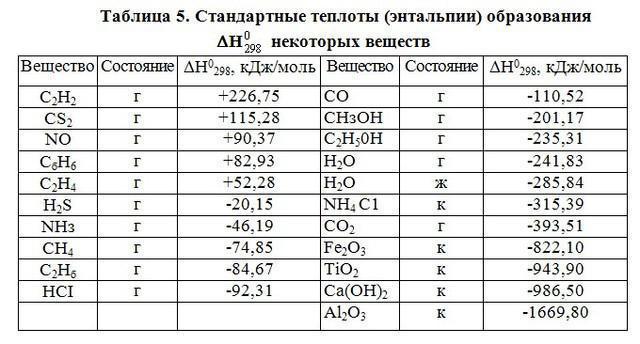
Ta izraz je predlagal H. Kamerlingh Onnes. Pri izvajanju termodinamičnih izračunov v anorganski kemiji je treba upoštevati količino snovi. Izračuni se izvajajo pri temperaturi, ki ustreza 298 K, tlaku 101 kPa.
Zakon Hess, ki je glavni parameter za sodobno termokemijo, nam omogoča, da določimo možnost spontanega poteka kemijskega procesa, da izračunamo njegov toplotni učinek.